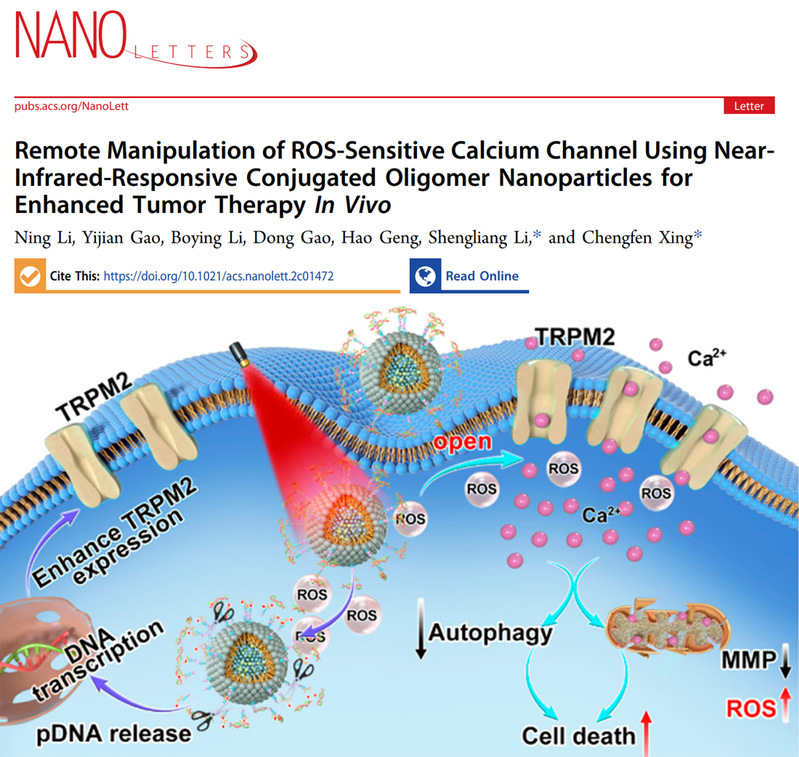
鈣離子是一種重要的細胞信號,在生物發育生長以及生理響應等多個過程中扮演舉足輕重的角色。鈣信號一直是生物學以及醫學科學家的重點研究對象,而且鈣信號與多種人類重大疾病的發生與發展密切相關。在過去的幾十年時間,科學家們一直試圖調控鈣信號從而達到對生物過程的有效控制,以及實現對疾病的精準治療。近十年以來涌現了主要包括光遺傳學在內的新興技術應用于在體與離體鈣信號調節,并取得了一系列重要的研究成果。但是,該類方法仍在創傷以及安全性等方面存在一定程度的缺陷和問題,影響了該技術的進一步使用。因此,如何遠程無創、安全有限的深層組織內鈣信號調控仍是當前的重大挑戰。圖1. 近紅外響應性多功能性納米載體系統的設計原理及工作機制近年來,蘇州大學李盛亮團隊通過調控近紅外光學治療藥物的分子結構與構效關系,發展了一系列具有高效光治療活性與發光性能的藥物體系與載體系統,從而實現了高性能的近紅外腫瘤診療聯合作用(Adv. Mater. 2022, 34, 2201263; Adv. Mater. 2021, 33, 2102799; Adv. Mater. 2020, 32, 2001146; Angew. Chem. Int. Ed. 2021, 133, 11864; ACS Nano 2020, 14, 13681; ACS Nano 2020, 14, 9917; ACS Nano 2019, 13, 12901; Adv. Sci. 2021, 8, 2003972; Mater. Horiz. 2021, 8, 571; Chem. Sci. 2020, 11, 888)。在上述工作基礎上,該團隊近期與河北工業大學邢成芬教授合作,構建了基于近紅外光敏劑的多功能納米載體,實現了鈣離子通道的調控以及鈣級聯介導的腫瘤細胞死亡。該研究首先建立了一種負載TRPM2質粒的多功能納米載體,該載體系統在紅外光照射下一方面可以通過二硒鍵的響應性斷裂釋放TRPM2質粒從而增強TRPM2在腫瘤細胞中的表達,另一方面近紅外光產生活性氧物種可激活活性氧敏感的鈣通道蛋白TRPM2開啟,引發鈣內流以及鈣信號相關的信號通路級聯反應,包括線粒體損失以及抑制早期自噬等。電生理實驗進一步證實了近紅外光遠程、反復式的鈣信號調控性能。靜脈注射后,近紅外二區發光成像證實該載體系統可在腫瘤部位有效蓄積。與此同時,該低劑量近紅外光照射啟動的鈣離子信號以及級聯反應可實現高效的抗腫瘤治療活性,且具備良好的生物安全性。該研究的意義在于,利用近紅外光敏劑的多功能納米載體系統功能化策略,實現了同時遞送基因與鈣信號調控功能,發展了一種新型的近紅外激活活性氧敏感的鈣通道調控策略,為離子通道調控與抗腫瘤治療提供了新的思路。
參考文獻:Ning Li, Yijian Gao, Boying Li, Dong Gao, Hao Geng, Shengliang Li*, and Chengfen Xing,* Remote Manipulation of ROS-Sensitive Calcium Channel Using Near-Infrared-Responsive Conjugated Oligomer Nanoparticles for Enhanced Tumor Therapy In Vivo. Nano Lett. 2022, 10.1021/acs.nanolett.2c01472.
https://pubs.acs.org/doi/10.1021/acs.nanolett.2c01472
李盛亮,蘇州大學特聘教授,博士生導師。研究聚焦于發展新型藥物與探針實現精準與高效低毒的重大疾病治療、生物成像和生物活性調控。近年以第一或通訊作者發表高水平SCI論文90余篇,其中包括以第一或通訊作者在Adv. Mater., Angew. Chem. In. Ed.等國際權威刊物上發表的論文40余篇,其中ESI高被引論文3篇(TOP 1%)。H指數為34,授權中國專利4項,申請PCT 國際專利 4項,參與撰寫2本納米材料領域書籍。同時長期擔任Angew. Chem. In. Ed., Adv. Mater., ACS Nano, Adv. Funt. Mater.等諸多國際學術期刊的審稿人。主要研究方向:光學藥物、探針以及納米醫學。
參考資料:http://pharm.suda.edu.cn/ac/84/c28610a502916/page.htm