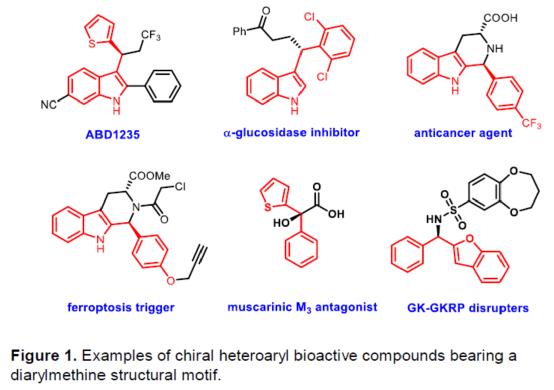
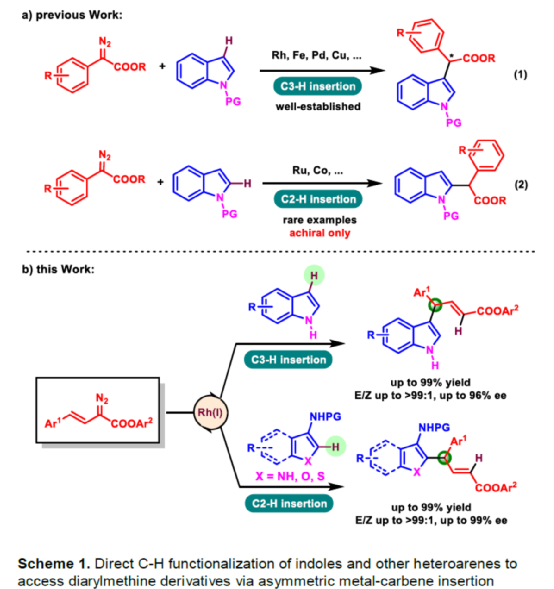
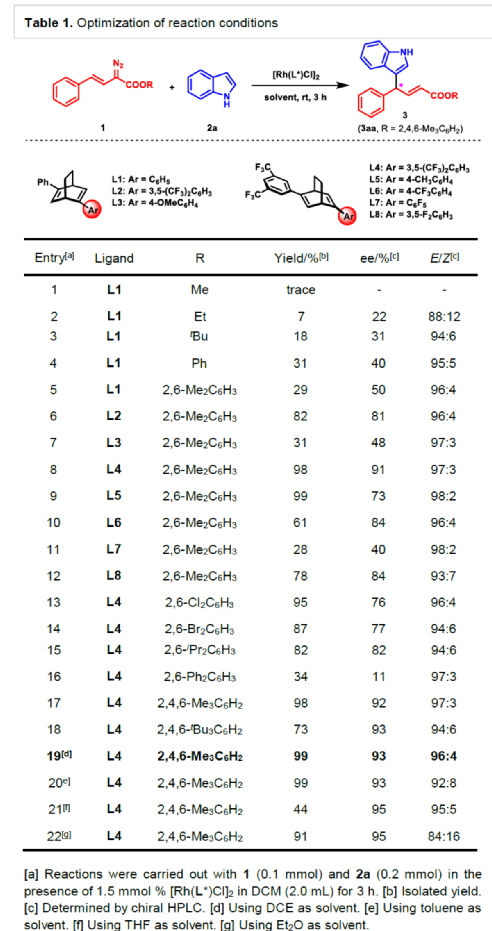
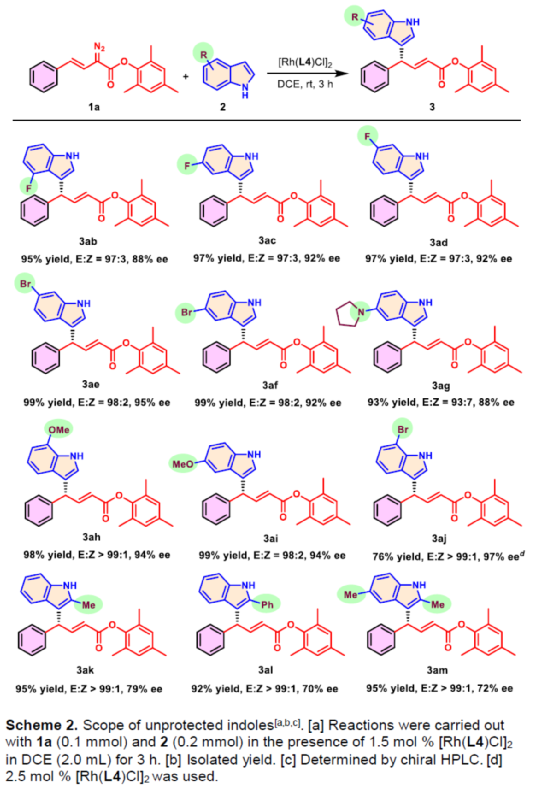
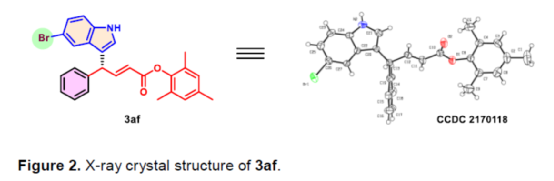
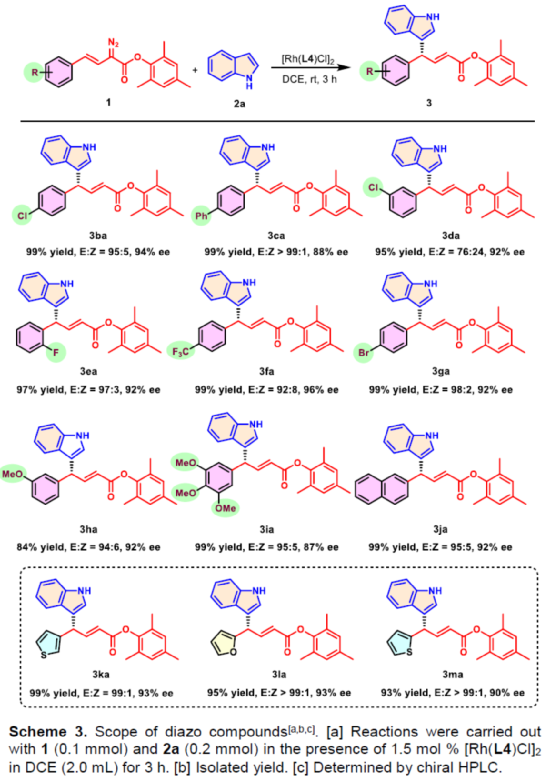
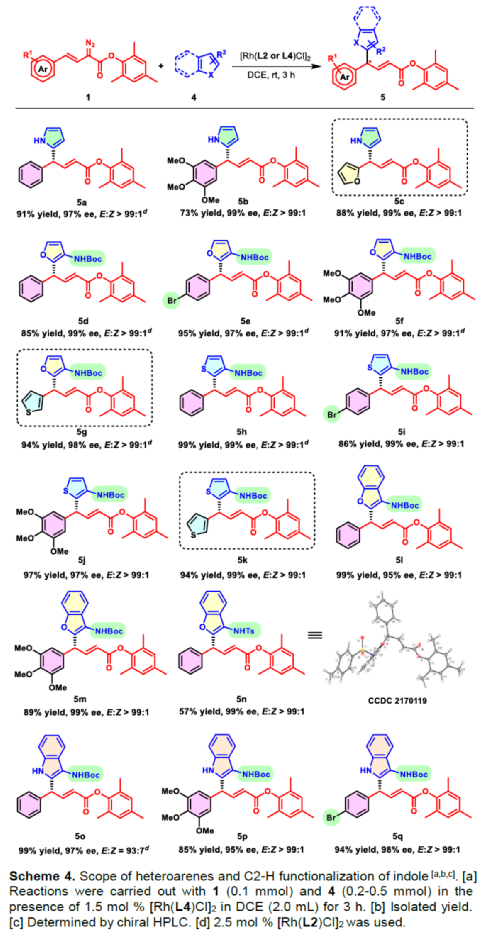
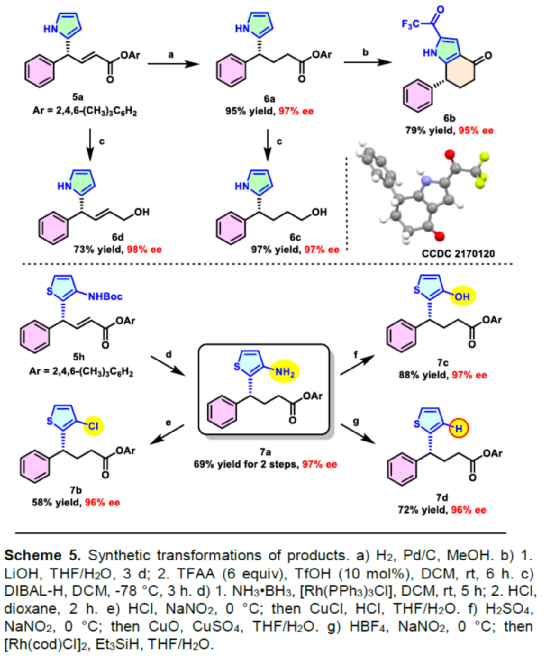
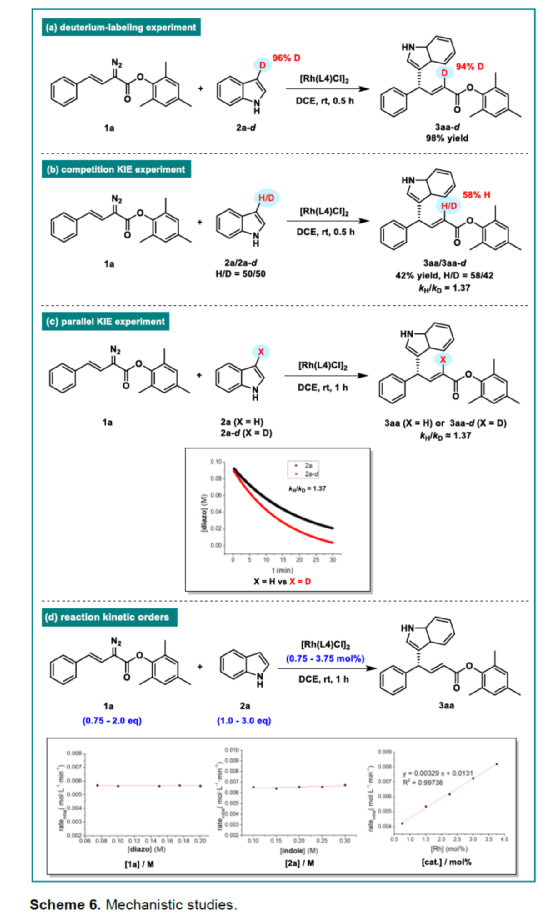
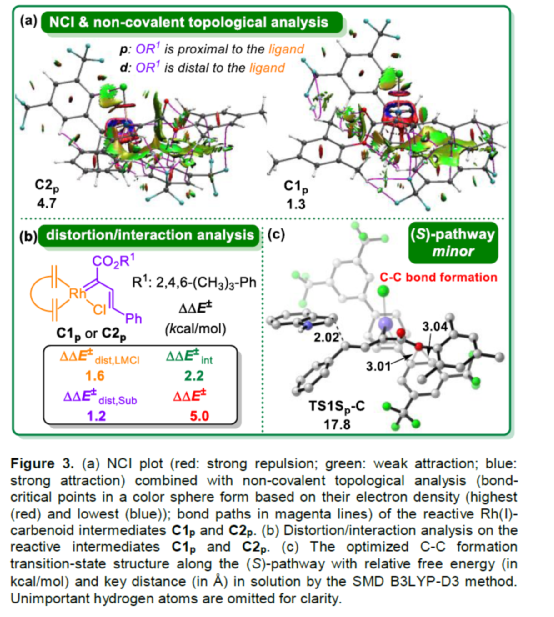
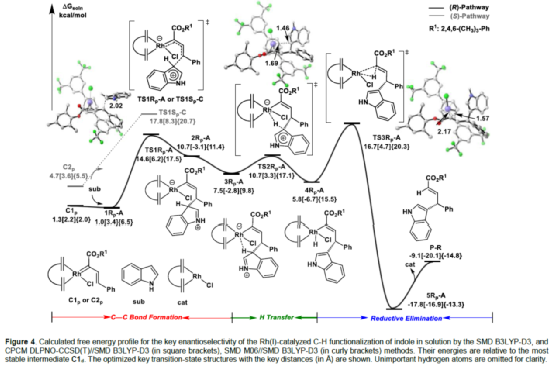
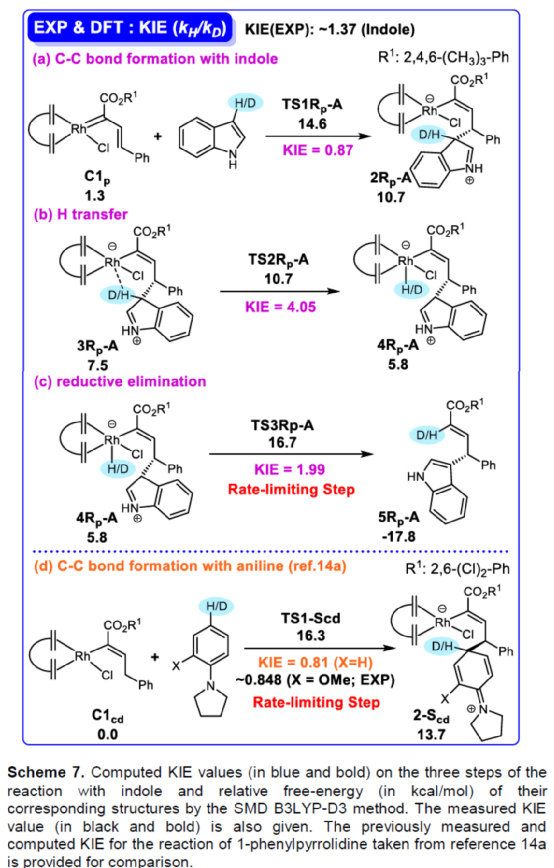
(圖片來源:Angew. Chem. Int. Ed.)含有叔碳立體中心的手性二芳基次甲基骨架廣泛存在于各類天然產物、生物活性化合物和合成分子中。特別是,含有吲哚或其它雜芳烴的手性偕-二芳基分子是一類具有多種生物學和藥學特性的獨特化合物(Figure 1)。(圖片來源:Angew. Chem. Int. Ed.)近些年,化學家們已開發出多種構建此類化合物的優雅方法。其中,金屬卡賓誘導的α-重氮羰基化合物與吲哚的不對稱C3-H鍵插入反應是一種具有吸引力的方法,并且手性Rh(II)、Fe(II)、Pd(II)、Cu(I)和Ir(III)配合物已成功用于該轉化(Scheme 1a, eq 1)。最近,也有文獻報道了有機催化吲哚和亞砜型葉立德(sulfoxonium ylides)的不對稱C3-H鍵插入反應。然而,上述的反應僅獲得對映體富集的α-(3-吲哚基)-α-芳基乙酸酯。同時,大多數例子將底物中的NH鍵進行保護,從而導致額外的脫保護步驟。此外,由于吲哚的C3-和N1-位固有的親核反應性以及對其反應中對映選擇性的控制難題,導致吲哚的催化不對稱C2-H鍵官能團化反應仍有待進一步的探索,涉及類卡賓插入(Scheme 1a, eq 2)。基于前期工作的總結(J. Am. Chem. Soc. 2021, 143, 2608.;J. Am. Chem. Soc. 2021, 143, 8583.),近日,南方科技大學徐明華課題組報道了銠(I)催化未保護吲哚與芳基乙烯基重氮乙酸酯的位點選擇性、直接C2-H/C3-H鍵的官能團化反應,涉及一種獨特的區域專一性和對映選擇性。同時,該策略還可用于含有游離NH鍵的吡咯和其它雜芳烴的不對稱C-H鍵插入反應(Scheme 1b)。(圖片來源:Angew. Chem. Int. Ed.)首先,作者以1與吲哚2a作為模型底物,進行了相關反應條件的篩選(Table 1)。當底物1中R為2,4,6-三甲基苯基時,以[Rh(L4)Cl]2作為催化劑,在DCE溶劑中室溫反應3 h,可以99%的收率得到產物3aa,ee為93%,E/Z為96:4。(圖片來源:Angew. Chem. Int. Ed.)在獲得上述最佳反應條件后,作者對未保護吲哚底物2的范圍進行了擴展(Scheme 2)。首先,當吲哚底物的苯環上含有鹵素、吡咯基、甲氧基、甲基等時,均可順利與1a反應,獲得相應的產物3ab-3aj,收率為76-99%,ee為88-97%,E/Z為93:7->99:1。其次,當吲哚底物的吡咯環上含有甲基、苯基時,也均與體系兼容,獲得相應的產物3ak-3am,收率為92-95%,ee為70-79%,E/Z>99:1。(圖片來源:Angew. Chem. Int. Ed.)通過晶體結構解析發現,3af的碳立體中心的絕對構型為R,C=C鍵的幾何構型為E(Figure 2)。(圖片來源:Angew. Chem. Int. Ed.)緊接著,作者對重氮酯底物1的范圍進行了擴展(Scheme 3)。首先,當底物1中的末端烯烴上含有一系列不同電性取代的芳基時,均可順利與2a反應,獲得相應的產物3ba-3ia,收率為84-99%,ee為87-96%,E/Z為76:24->99:1。其中,當使用3-氯取代的芳基乙烯基重氮酯時,E/Z僅為76:24,但收率和對映選擇性不受影響,如3da。其次,底物1中的末端烯烴取代為萘基、呋喃基、噻吩基時,均與體系兼容,獲得相應的產物3ja-3ma,收率為93-99%,ee為90-93%,E/Z為95:5->99:1。(圖片來源:Angew. Chem. Int. Ed.)除了未保護的吲哚底物以外,其它常見雜環化合物(如吡咯、呋喃、噻吩、苯并呋喃等),均與體系兼容,獲得相應的產物5a-5q,收率為73-99%,ee為95-99%,E/Z為93:7->99:1(Scheme 4)。值得注意的是,上述的策略均獲得C2-位官能團化的產物,并與C3-位官能團化的產物形成互補,進一步體現了反應的區域專一性。然而,3-NHBoc取代的苯并噻吩和3-NHTs取代的噻吩底物,具有較差的反應性。(圖片來源:Angew. Chem. Int. Ed.)緊接著,作者對反應的實用性進行了研究(Scheme 5)。首先,5a經Pd/C催化的氫化反應可生成4-苯基-4-(1H-吡咯-2-基)丁酸酯6a,收率為95%,ee為97%。6a經水解以及分子內Friedel-Crafts酰化反應,可以79%的收率獲得吡咯稠合雙環化合物6b,ee為95%。在DIBAL-H條件下,5a中的酯基可選擇性地還原成相應的醇而不影響雙鍵,獲得73%收率的烯丙醇化合物6d,ee為98%。同樣,6a也可轉化為6c,收率為97%,ee為97%。其次,5h經氫化與脫保護過程,可以69%的收率獲得含有氨基的化合物7a,ee為97%。7a中的氨基可進一步轉化為氯與羥基,且ee不受影響。值得注意的是,通過該策略還可合成對映體富集的γ-噻吩基-γ-苯基丁酸酯7d,這是通過以前非活化噻吩直接C-H官能團化反應不易實現的。(圖片來源:Angew. Chem. Int. Ed.)此外,作者還對反應機理進行了進一步的研究(Scheme 6)。首先,通過氘標記與平行KIE實驗表明,決速步在催化循環過程已經不再是和吲哚的C-C形成步驟(Schemes 6a-6c)。同時,通過原位紅外研究表明,反應對銠-二烯催化劑表現出一級動力學,對重氮化合物1a和吲哚2a均表現出零級動力學(Scheme 6d)。因此,兩種反應物對金屬類卡賓中間體的形成幾乎沒有影響,從而表明重氮化合物的分解步驟和吲哚加成步驟都不是決速步驟。(圖片來源:Angew. Chem. Int. Ed.)同時,通過相關的DFT計算以及相關KIE實驗研究表明,在C-C加成步驟之后,兩性離子中間體2Rp-A發生輕微的重排得到3Rp-A,隨后經低能壘的質子轉移,生成中性和五配位Rh(III)-氫化乙烯基中間體4Rp-A,最后經還原消除得到主要(R)-產物5Rp-A并再生活性催化劑(Figure 4)。值得注意的是,富電子的吲哚底物可降低C-C加成的能壘,并且還原消除是決速步驟。(圖片來源:Angew. Chem. Int. Ed.)(圖片來源:Angew. Chem. Int. Ed.)(圖片來源:Angew. Chem. Int. Ed.)總結:南方科技大學徐明華課題組首次報道了一種銠(I)/手性二烯催化的簡單無保護吲哚、吡咯及其類似物(如呋喃、噻吩和苯并呋喃)與芳基乙烯基重氮酯的對映選擇性C-H鍵的官能團化反應,從而合成了一系列含有二芳基次甲基的α,β-不飽和酯。同時,通過微調吲哚環上的電子密度,可實現了游離(NH)-吲哚的C2-H和C3-H位點專一性不對稱官能團化反應。機理和DFT計算研究表明,富電子的吲哚底物會降低C-C加成勢壘,并且還原消除是決速步驟。
文章詳情:
Rhodium(I) Carbene-Promoted Enantioselective C-H Functionalization of Simple Unprotected Indoles, Pyrroles and Heteroanalogues: New Mechanistic Insights
Ming-Hua Xu,Tian-Yi Wang,Xiao-Xuan Chen,Dong-Xing Zhu,Lung Wa Chung
https://doi.org/10.1002/anie.202207008