

癌癥是人類健康的巨大威脅,由于癌細胞具有高度侵襲性,癌細胞轉移是癌癥患者死亡的主要誘因。因此,轉移抑制是許多癌癥相關療法的主要關注點。隨著超分子納米組裝的發展,原位自組裝納米纖維在癌細胞中表現出長期保留特性并顯著抑制其轉移行為。因此,通過合理設計外源性或內源性刺激反應的肽偶聯物,將其用于原位構建納米纖維以全面抑制腫瘤轉移是可行的。
此外,對于癌癥轉移形成的遠端腫瘤的抑制在臨床癌癥治療中也很重要。近年來,通過化學療法和免疫療法的結合,化學免疫療法被廣泛用于來提高癌癥治療效率、逆轉耐藥性并最大限度地減少副作用。值得注意的是,越來越多的證據表明,化療藥物誘導的癌細胞凋亡/壞死可有效激活免疫系統以產生與腫瘤相關的新抗原。具體而言,化療誘導的癌細胞免疫原性細胞死亡(ICD)促進了抗原從細胞中的釋放。然后,釋放的抗原被成熟樹突狀細胞(DC)吸收,并隨后激活細胞毒性T淋巴細胞(CTL)以殺死癌細胞。不過,這種化療后的免疫反應在抑制腫瘤轉移方面不夠理想。因此,癌癥免疫治療(即免疫檢查點阻斷)與自噬抑制增強化療的組合對腫瘤生長、轉移和侵襲具有顯著的抑制作用。基于此,梁高林課題組設計了一種具有納米刷-納米粒子-納米纖維轉變特性的“三叉戟”前藥分子Nap?CPT?HCQ?Yp,通過細胞內納米纖維的形成抑制原發性腫瘤轉移,并通過化學免疫療法抑制遠端腫瘤的生長,從而在空間上抑制腫瘤轉移。
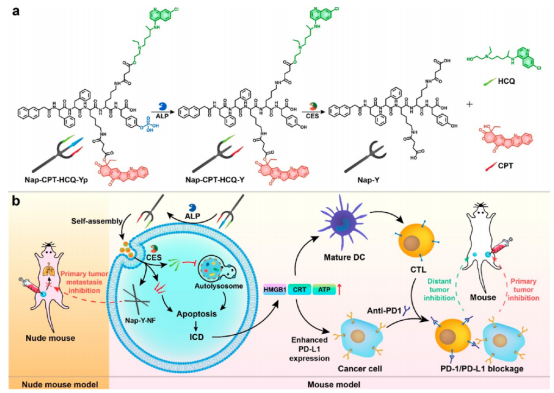
圖 1. 三叉戟前藥分子結構及作用示意圖(圖片來源:J. Am. Chem. Soc.)
三叉戟前藥分子Nap?CPT?HCQ?Yp自組裝肽骨架中包含三個功能性“矛”:(1)磷酸酪氨酸基團,作為堿性磷酸酶(ALP)催化的底物;(2)喜樹堿(CPT,一種化療藥物);(3)羥氯喹(HCQ,一種自噬抑制劑)。其中,CPT和HCQ通過細胞內羧酸酯酶(CES)可催化裂解的酯鍵與肽支架結合。Nap-CPT-HCQ-Yp在濃度高于6.3 μM時形成納米刷結構。在癌細胞膜上與ALP作用去磷酸化后,Nap-CPT-HCQ-Yp首先轉化為Nap-CPT-HCQ-Y,納米刷轉變為納米粒子。癌細胞內吞后,Nap-CPT-HCQ-Y在細胞質中進行CES水解,納米粒子進一步轉化為納米纖維Nap-Y-NF,同時伴隨著CPT和HCQ的釋放。首先,Nap-Y-NF納米纖維的細胞內形成抑制了癌細胞的遷移和侵襲能力。其次,釋放的HCQ通過抑制癌細胞的自噬來抑制癌細胞的自我保護過程,使它們對CPT的化學治療作用更加敏感。此外,自噬抑制增強化療誘導癌細胞凋亡/壞死,并伴有片段產生。這些片段隨后誘導癌細胞的ICD,促進抗原從細胞中釋放。然后,釋放的抗原被成熟的樹突狀細胞(DCs)吸收和呈遞,導致CTL激活以殺死癌細胞。然而,化療誘導的ICD提高了癌細胞上PD-L1的表達。PD-L1與CTL上的PD-1結合,降低了CTL的殺傷能力。為了解決這個問題,作者用檢查點阻斷療法補充了上述策略,以引發全身免疫反應,從而有效抑制原發性腫瘤和遠端腫瘤(圖1)。
首先,作者通過HPLC分析證明了Nap?CPT?HCQ?Yp具有良好的穩定性以及驗證了三叉戟前藥對ALP和CES的雙重響應性,并且利用TEM表征驗證了前藥分子在酶觸發下的納米刷-納米粒子-納米纖維轉變。在10 μM的濃度下,Nap-CPT-HCQ-Yp最初自組裝成不均勻的納米刷構型,經ALP去磷酸化24 h后,納米刷進一步轉化為平均直徑為86.8±29.4 nm的 Nap-CPT-HCQ-Y納米粒子,之后通過CES水解24 h后,形成的納米粒子最終轉化為平均寬度為14.2±3.9 nm的Nap-Y-NF納米纖維。此外,作者還在體外研究了Nap-CPT-HCQ-Yp的酶促凝膠特性(圖2)。
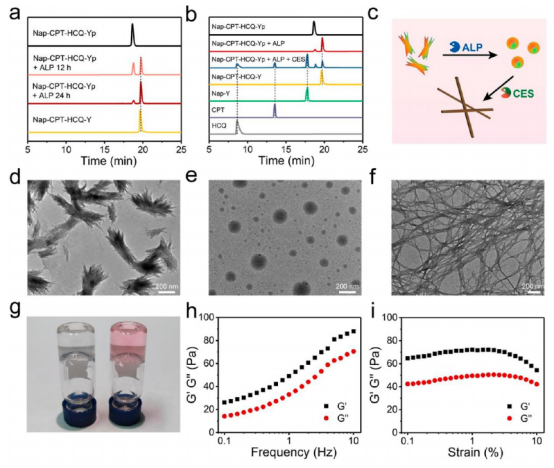
圖 2. 酶處理前后三叉戟前藥分子的表征(圖片來源:J. Am. Chem. Soc.)
接著,作者在過表達ALP和CSE的4T1細胞中對酶促納米結構轉變的概念進行了驗證(圖3)。Nap-CPT-HCQ-Yp可以有效地進入細胞,并最初主要位于溶酶體中,后續會發生溶酶體逃逸行為。通過Bio-TEM觀察到前藥分子處理前后4T1細胞中的溶酶體結構發生明顯的異常,表明三叉戟分子形成的納米纖維Nap-Y-NF可以破壞溶酶體結構,從而促進從溶酶體中逃逸。而且,實驗證明Nap-CPT-HCQ-Yp的內化涉及ATP依賴性轉運和小窩依賴性內吞作用。在與細胞孵育8 h時,在細胞質中發現了大量的納米纖維,表明大部分Nap-CPT-HCQ-Yp已轉化為Nap-Y并自發形成納米纖維Nap-Y-NF。此外,作者還設計了劃痕傷口愈合試驗證明了納米纖維的形成可以抑制癌細胞遷移。
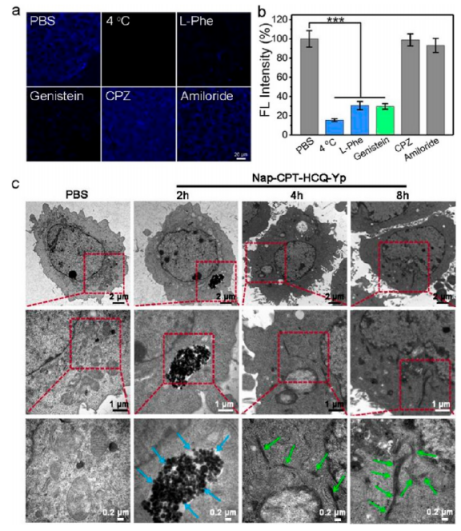
圖 3. Nap-CPT-HCQ-Yp的細胞攝取、定位和細胞內納米結構轉變(圖片來源:J. Am. Chem. Soc.)
接著,作者結合細胞毒性和蛋白質印跡分析試驗驗證了自噬抑制策略顯著提高了三叉戟分子Nap-CPT-HCQ-Yp對癌細胞的化療效果,甚至比兩種游離藥物CPT和HCQ的效果更好。然后,作者進一步探討了Nap-CPT-HCQ-Yp處理的凋亡癌細胞是否可以觸發它們的下游ICD,并通過酶聯免疫吸附測定(ELISA)和流式細胞術研究了ICD相關生物標志物的水平,證實了Nap-CPT-HCQ-Yp的治療可以觸發癌細胞有效地產生ICD(圖4)。
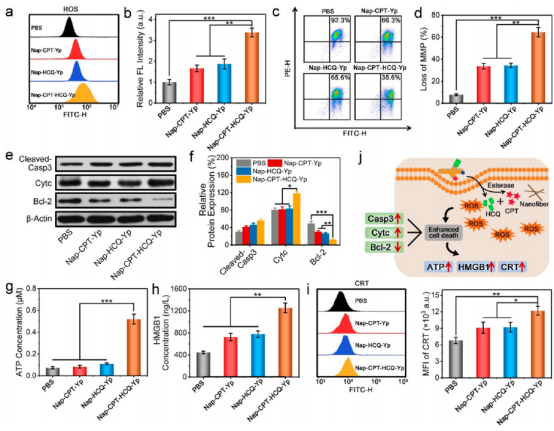
圖 4. Nap-CPT-HCQ-Yp的細胞治療機制和誘導的免疫原性細胞死亡(圖片來源:J. Am. Chem. Soc.)
然后,作者評估了前藥在體內抑制腫瘤轉移的效果。與對照組相比,Nap?CPT?HCQ?Yp處理的小鼠腫瘤得到了明顯的抑制,并且可以最顯著地抑制腫瘤的肺轉移。在治療過程,Nap?CPT?HCQ?Yp還表現出優異的生物安全性。值得注意的是,由于Nap-CPT-HCQ-Yp注射略微提高了腫瘤PD-L1的表達,作者進一步評估了Nap-CPT-HCQ-Yp和免疫檢查點阻斷PD-1抗體對4T1荷瘤小鼠的協同化學免疫治療功效。結果表明,“Nap-CPT-HCQ-Yp + aPD-1”的組合對原發性腫瘤的抑制效果最好。而且通過對包括CRT和HMGB1在內的相關生物標志物進行免疫熒光染色研究了體內ICD的產生,證實了通過組合“Nap-CPT-HCQ-Yp + aPD-1”治療有效產生ICD。此外,作者還在該組合治療的原發性腫瘤中觀察到最大量的活化細胞毒性T細胞,表明組合策略最大限度地激活了原發性腫瘤的免疫反應。重要的是,Nap-CPT-HCQ-Yp和免疫檢查點阻斷PD-1抗體的組合還實現了對遠端腫瘤生長的顯著抑制(圖5)。

圖 5. 體內自噬抑制增強化療聯合aPD-1抗體抑制原發性和遠端腫瘤生長(圖片來源:J. Am. Chem. Soc.)
總結:東南大學梁高林教授團隊合理設計了一種具有納米刷-納米粒子-納米纖維過渡特性的“三叉戟”分子Nap-CPT-HCQ-Yp,在堿性磷酸酶和羧酸酯酶連續作用下,Nap-CPT-HCQ-Yp經歷納米刷-納米粒子-納米纖維轉變,并伴隨著CPT和HCQ的釋放。形成的細胞內納米纖維有效抑制癌細胞的轉移和侵襲行為。同時,釋放的CPT和HCQ通過自噬抑制增強化療協同誘導顯著的治療效果。此外,Nap-CPT-HCQ-Yp的化學療法增強了免疫原性細胞死亡,導致毒性T細胞的活化。最后,檢查點阻斷療法和Nap-CPT-HCQ-Yp介導的化學療法相結合可引發全身抗腫瘤免疫,從而在乳腺癌腫瘤模型中實現對原發性腫瘤和遠處腫瘤的有效抑制。該工作為設計“智能”多功能前藥以空間抑制腫瘤轉移提供了一種簡單可行的策略。
文章詳情:
Trident Molecule with Nanobrush–Nanoparticle–Nanofiber Transition Property Spatially Suppresses Tumor Metastasis
Ge Gao, Yao-Wen Jiang, Wenjun Zhan, Xiaoyang Liu, Runqun Tang, Xianbao Sun, Yu Deng, Lingling Xu, and Gaolin Liang*
https://doi.org/10.1021/jacs.2c05743

聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn