- 首頁
- 資訊
Nat. Commun. 西農(nóng)常明欣課題組銥催化的直接不對稱還原胺化反應(yīng)
來源:化學(xué)加原創(chuàng) 2022-06-28
導(dǎo)讀:近日,西北農(nóng)林科技大學(xué)常明欣課題組開發(fā)了一種銥與手性亞磷酰胺配體的催化體系,可實現(xiàn)酮與伯烷基胺(作為氮源)的不對稱還原胺化反應(yīng)。機(jī)理研究表明,反應(yīng)涉及outer-sphere氫化物加成的過程,其中兩個氫鍵相互作用對于反應(yīng)至關(guān)重要,即亞磷酰胺手性配體的(P)O與烷基胺(N)H之間的氫鍵以及銥中的氯與亞胺中的(N)H鍵之間的氫鍵。此外,通過該策略可直接合成西那卡塞、tecalcet、芬地林以及其它相關(guān)的手性胺,具有優(yōu)異的收率和對映選擇性。文章鏈接DOI:10.1038/s41467-022-31045-5
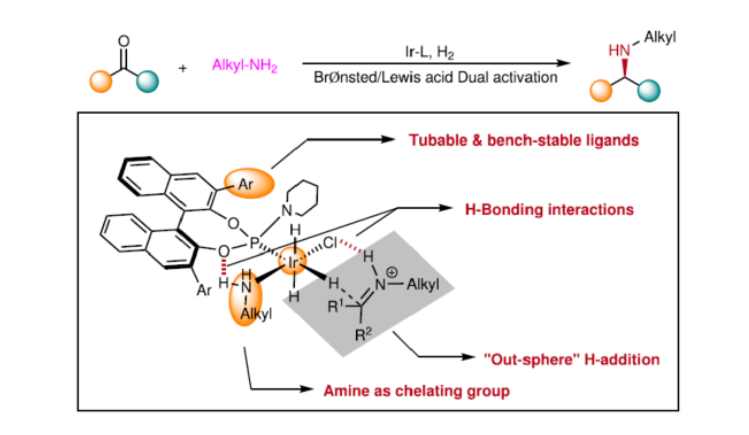
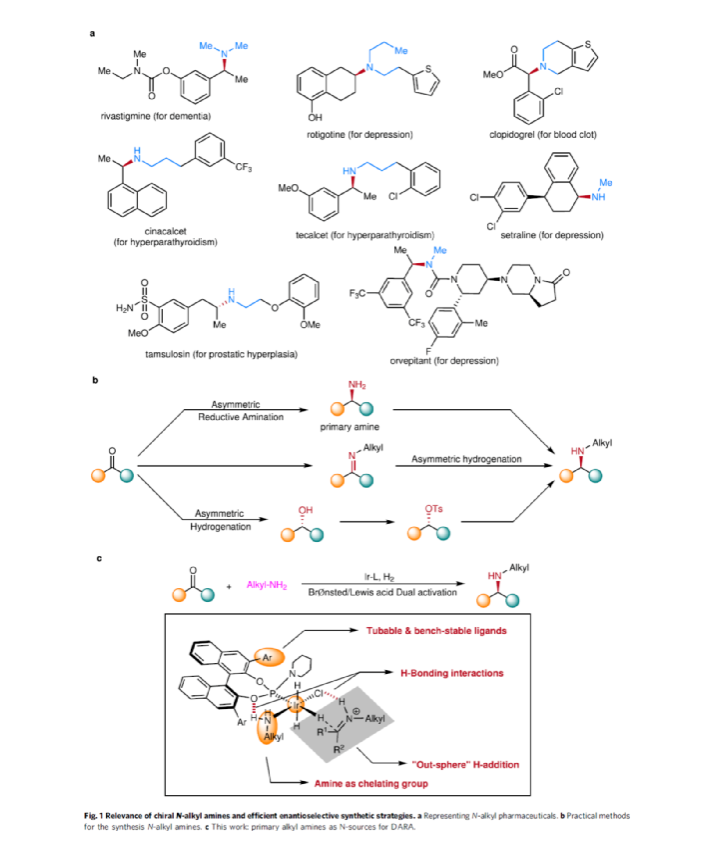
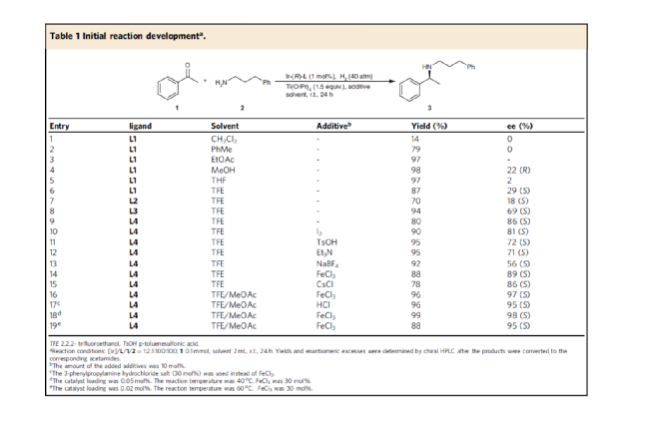
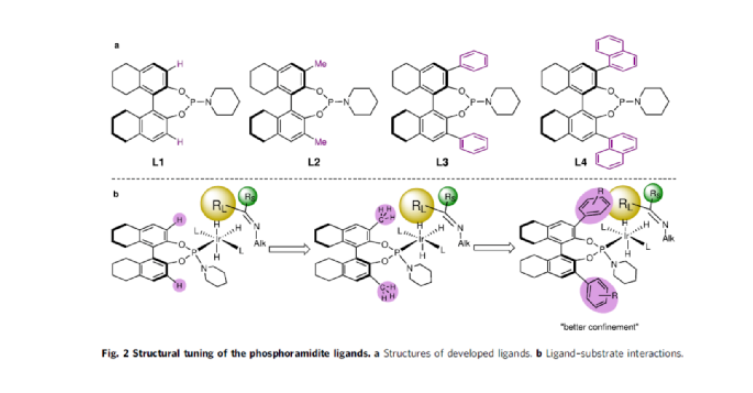
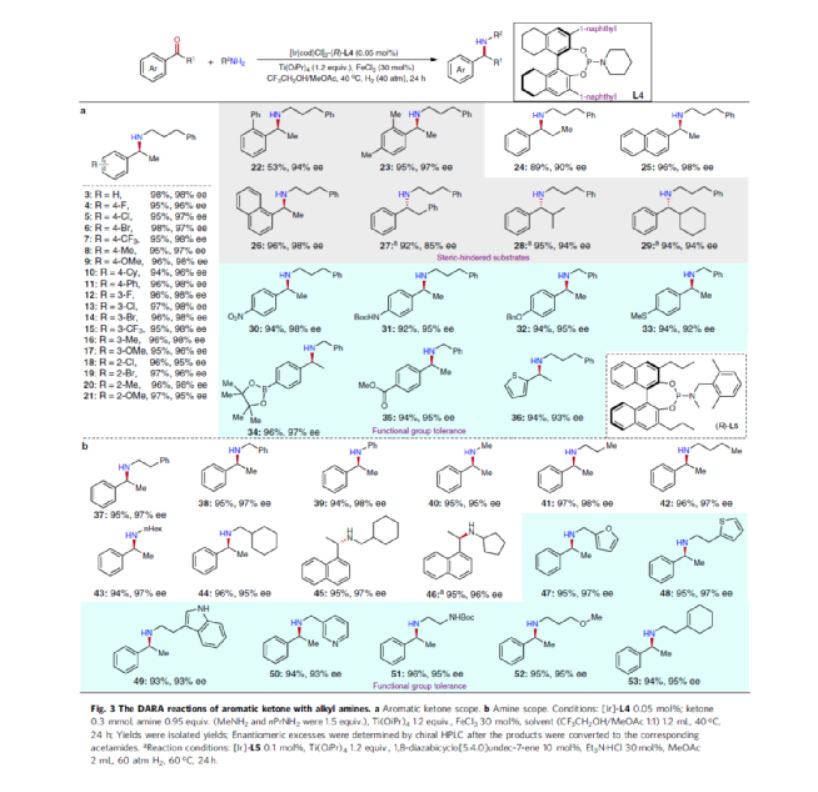
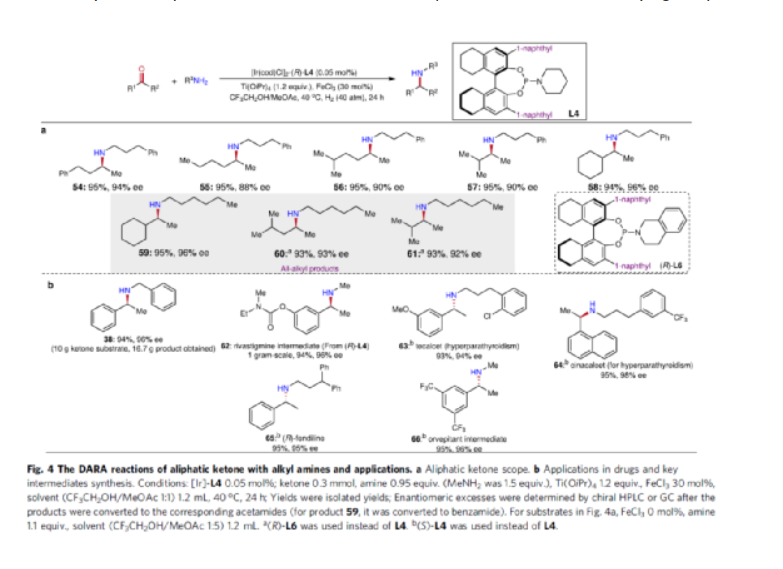
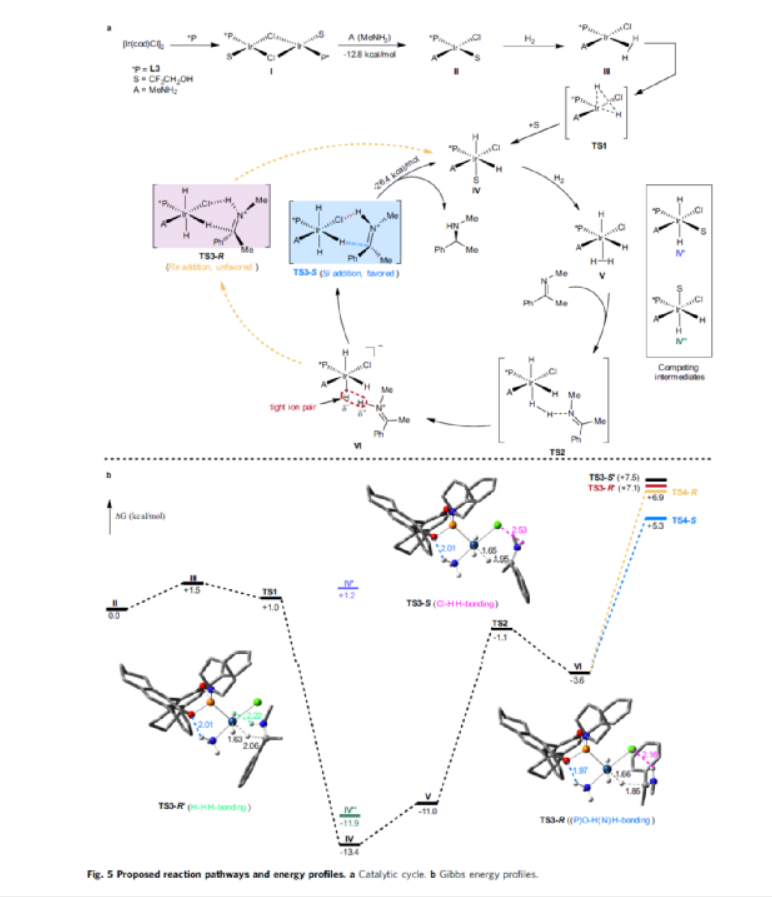
手性N-烷基胺廣泛存在于各類活性藥物中(Fig. 1a)。目前,不對稱氫化和還原胺化反應(yīng)是兩種實用且高效的合成策略(Fig. 1b)。其中,直接不對稱還原胺化反應(yīng)(DARA)是構(gòu)建手性胺最為有效的方法之一,可通過一步反應(yīng)直接實現(xiàn)酮與胺的偶聯(lián),從而避免了不對稱氫化反應(yīng)中的多步反應(yīng)過程。雖然過渡金屬催化DARA已取得了一定的進(jìn)展,但胺的偶聯(lián)底物范圍仍非常有限。除了分子內(nèi)的DARAs,大多數(shù)DARAs的氮源通常分為三類:(1)無機(jī)銨鹽/氨,用于合成伯胺;(2)芳香胺,可生成手性仲胺;(3)仲胺源,用于構(gòu)建手性叔胺。同時,還存在一些特殊的胺類,如芐胺、二苯甲胺、肼、酰肼等。前期,在過渡金屬催化DARAs中,僅有一個使用烷基胺(MeNH2)作為氮偶聯(lián)底物的例子,以及一些其它特殊的烷基胺(如芐胺、二苯甲胺和烯丙胺)。同時,N-烷基亞胺不對稱氫化直接合成N-烷基胺的文獻(xiàn)也非常少,其中在兩種情況下,N-烷基胺原位轉(zhuǎn)化為NSiH2Ph和N-Boc產(chǎn)物,以降低對催化劑的抑制作用。此外,限制DARA反應(yīng)的主要原因在于烷基不能通過次級相互作用(如氫鍵、π-效應(yīng)和靜電相互作用)與功能性催化物種配位或發(fā)生相互作用。作者設(shè)想,是否可利用空間可調(diào)節(jié)的手性配體,能夠在催化過程中有效地限制烷基的位置以及添加劑的加速作用,從而解決上述的問題。在此,西北農(nóng)林科技大學(xué)常明欣課題組報道了一種銥亞磷酰胺配合物催化酮與伯烷基胺的高效不對稱還原胺化反應(yīng),合成了一系列手性N-烷基仲胺衍生物(Fig. 1c)。其中,使用空間位阻更大的3,3'-1-萘基取代基的亞磷酰胺手性配體可控制反應(yīng)的對映選擇性,且烷基和催化配合物之間沒有次級相互作用。機(jī)理研究表明,反應(yīng)涉及outer-sphere氫化物加成的過程,其中兩個氫鍵相互作用對于反應(yīng)至關(guān)重要。首先,作者以苯乙酮1與3-苯基-1-丙胺2作為模型底物,進(jìn)行了不對稱還原胺化反應(yīng)條件的篩選(Table 1)。當(dāng)以[Ir(cod)Cl]2-(R)-L4作為催化劑,KOtBu作為堿,F(xiàn)eCl3與Ti(OiPr)4作為添加劑,在CF3CH2OH/MeOAc的混合溶劑中于氫氣氛圍(40 atm)中反應(yīng),可以99%的收率和98%ee獲得產(chǎn)物3。在獲得上述最佳反應(yīng)條件后,作者對底物范圍進(jìn)行了擴(kuò)展(Fig. 3)。首先,苯乙酮的芳基上含有不同電性取代基時,均可順利與3-苯基丙胺2反應(yīng),獲得相應(yīng)的產(chǎn)物4-21,收率為94-98%,ee為95-98%。對于含有空間位阻的芳香酮底物,也與體系兼容,獲得相應(yīng)的產(chǎn)物22-23和26-29,收率為53-96%,ee為85-98%。值得注意的是,當(dāng)使用L5作為手性配體時,可獲得相反構(gòu)型的產(chǎn)物27-29。同時,苯乙酮的芳基上含有-NO2、-OBn、-SMe、-NHBoc、-CO2Me等時,均與體系兼容,獲得相應(yīng)的產(chǎn)物30-35,收率為92-96%,ee為92-98%。2-乙酰噻吩也是合適的底物,以94%的收率和93%ee獲得產(chǎn)物36。其次,一系列不同取代的烷基伯胺與芐胺,均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物37-46,收率為92-96%,ee為95-98%。同時,含有雜芳基取代的伯胺,也是合適的底物,獲得相應(yīng)的產(chǎn)物47-50,收率為93-95%,ee為93-97%。對于含有-NHBoc、烯基和甲氧基取代的伯胺底物,也與體系兼容,獲得相應(yīng)的產(chǎn)物51-53,收率為94-96%,ee均為95%。同時,作者發(fā)現(xiàn),除了芳香酮底物外,含有直鏈、支鏈和環(huán)狀的脂肪族酮底物均可與烷基胺順利反應(yīng),獲得相應(yīng)的產(chǎn)物54-58,收率為94-95%,ee為88-96%。其次,通過該策略還可合成一系列全烷基胺產(chǎn)物59-61,收率為93-95%,ee為92-96%(Fig. 4a)。并且,當(dāng)使用手性L6作為配體時,可使產(chǎn)物60和61具有更高的對映選擇性。值得注意的是,克級規(guī)模實驗,同樣能夠以94%收率和96%ee得到產(chǎn)物38。此外,通過該策略可合成一系列藥物以及相應(yīng)的藥物中間體,如替卡塞(Tecalcet)、芬地林、卡巴拉汀與Orvepitant的關(guān)鍵中間體等(Fig. 4b)。基于DFT計算的研究以及相關(guān)文獻(xiàn)的查閱,作者提出了一種合理的催化循環(huán)過程(Fig. 5)。首先,甲胺與Ir配位可破壞二聚體I(由[Ir(cod)Cl]2與L3原位生成),生成配合物II。配合物II通過甲胺的(N)-H鍵和手性配體L3的(P)-O鍵之間的氫鍵相互作用,從而使其穩(wěn)定(TS3-S)。緊接著,通過氧化加成生成Ir(III)中間體IV,其中H2被活化并通過過渡態(tài)TS1加成至Ir(I)配合物中。隨后,第二個H2更偏向與P的順式位配位而不是反式位(存在競爭性中間體IV'和IV''),從而生成配合物V。在亞胺底物的協(xié)助下,配合物V經(jīng)異裂(heterocleaves),生成的氫化物可與Ir加成生成離子對配合物VI,涉及過渡態(tài)TS2。值得注意的是,對映選擇性的起源發(fā)生在氫化物加成步驟中。最后,在熱力學(xué)上,氫化物從亞胺底物的Si-face加成更為有利(TS3-S),而非Re-face加成(TS3-R),從而獲得目標(biāo)產(chǎn)物并再生配合物IV,以完成催化循環(huán)。總結(jié):西北農(nóng)林科技大學(xué)常明欣課題組報道了一種銥亞磷酰胺配合物催化酮與伯烷基胺的高效不對稱還原胺化反應(yīng),合成了一系列手性N-烷基仲胺衍生物。同時,該策略具有廣泛的底物范圍、優(yōu)異的收率、優(yōu)異的對映選擇性等特點。此外,通過對藥物以及藥物中間體的合成,從而進(jìn)一步證明了反應(yīng)的實用性。機(jī)理研究表明,反應(yīng)涉及outer-sphere氫化物加成的過程,其中:亞磷酰胺手性配體的(P)O與烷基胺(N)H鍵以及銥中的氯與亞胺中的(N)H鍵兩個氫鍵相互作用對于反應(yīng)至關(guān)重要。Wu, Z., Wang, W., Guo, H. et al. Iridium-catalyzed direct asymmetric reductive amination utilizing primary alkyl amines as the N-sources. Nat Commun 13, 3344 (2022). https://doi.org/10.1038/s41467-022-31045-5

聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn