



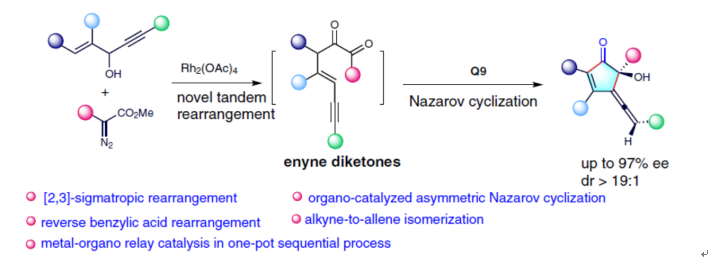
(圖片來(lái)源:Nat. Commun.)
手性環(huán)戊烯酮是一類(lèi)重要的結(jié)構(gòu)單元,廣泛存在于各類(lèi)天然產(chǎn)物和生物活性分子中(Fig. 1a)。Nazarov環(huán)化反應(yīng)是少數(shù)可通過(guò)手性催化劑以不對(duì)稱(chēng)方式控制的4π-電環(huán)化反應(yīng)的方法。因此,化學(xué)家一直致力于催化不對(duì)稱(chēng)Nazarov環(huán)化反應(yīng)的研究。2003年,Trauner課題組報(bào)道了首例不對(duì)稱(chēng)Nazarov環(huán)化反應(yīng)。隨后,二乙烯基酮的不對(duì)稱(chēng)Nazarov環(huán)化也被諸多研究團(tuán)隊(duì)研究(Fig. 1b)。然而,對(duì)于不對(duì)稱(chēng)Nazarov環(huán)化反應(yīng)的其它類(lèi)型底物,卻很少有相關(guān)的報(bào)道。2010年,Tius課題組報(bào)道了一種伯胺-硫脲催化劑催化乙烯基二酮酯的不對(duì)稱(chēng)Nazarov反應(yīng),獲得一系列手性環(huán)戊烯酮衍生物(Fig. 1c)。隨后,該小組還報(bào)道了一種鈀催化乙烯基二酮酯的對(duì)映選擇性Nazarov環(huán)化反應(yīng)。此外,F(xiàn)rontier課題組報(bào)道了一種二烯基二酮的Nazarov反應(yīng),但僅有七例不對(duì)稱(chēng)反應(yīng)的例子(Fig. 1d)。
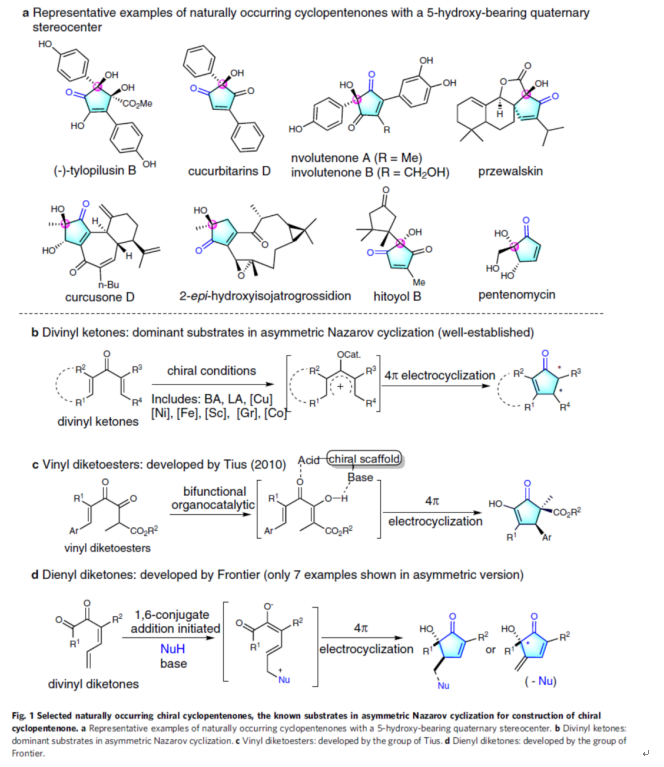
(圖片來(lái)源:Nat. Commun.)
盡管已取得了一定地進(jìn)展,但不對(duì)稱(chēng)Nazarov環(huán)化反應(yīng)的底物類(lèi)型仍非常有限。這里,常州大學(xué)孫江濤與唐生表課題組報(bào)道了一種金屬-有機(jī)接力催化的策略,可通過(guò)1,4-烯炔醇與重氮化合物構(gòu)建具有高非對(duì)映和對(duì)映選擇性的手性聯(lián)烯環(huán)戊烯酮(Fig. 2a)。其中,中間體烯炔二酮在不對(duì)稱(chēng)Nazarov環(huán)化反應(yīng)中起著關(guān)鍵的作用。
基于文獻(xiàn)的研究以及相關(guān)的實(shí)驗(yàn)總結(jié),作者提出了一種合理的反應(yīng)機(jī)理(Fig. 2b)。首先,銠催化劑與重氮乙酸酯1反應(yīng)生成銠卡賓配合物Int-1。2與Int-1的親核加成可生成中間體Int-2,其經(jīng)[2,3]-σ重排生成中間體Int-3。其次,Int-3經(jīng)逆向二苯乙醇酸重排生成1,2-二酮-烯炔中間體3。隨后,在手性硫脲催化劑存在下,中間體3經(jīng)氫鍵和酮-烯醇互變異構(gòu)生成中間體Int-4。Int-4經(jīng)分子內(nèi) Nazarov環(huán)化,生成含有兩個(gè)相鄰立體中心的環(huán)戊烯酮炔烴中間體Int-5。最后,Int-5經(jīng)炔烴到聯(lián)烯的異構(gòu)化以及中心手性向軸手性的傳遞過(guò)程,從而獲得最終產(chǎn)物(-)-4。
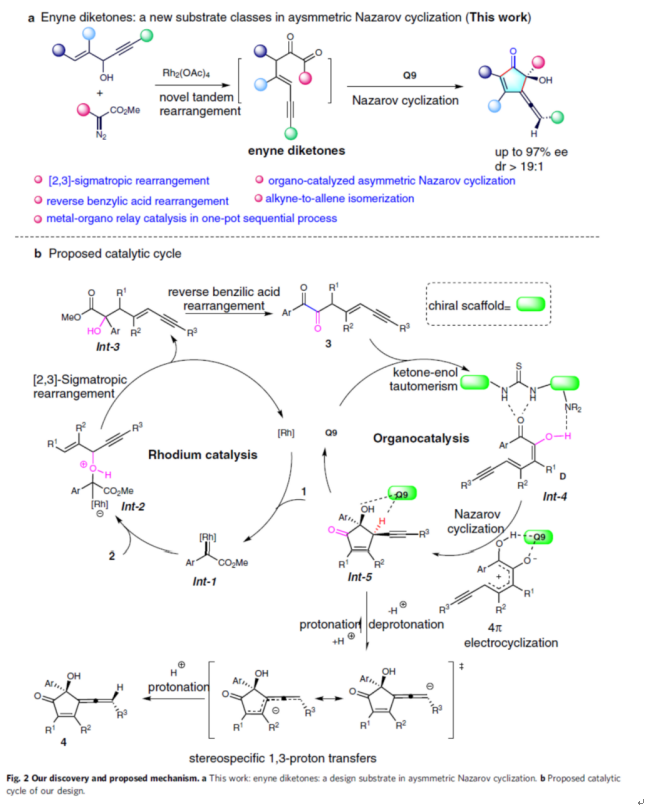
(圖片來(lái)源:Nat. Commun.)
首先,作者以芳基重氮乙酸酯1a與1,4-烯炔醇2a作為模型底物,進(jìn)行了相關(guān)反應(yīng)條件的篩選(Table 1)。當(dāng)以Rh2(OAc)4作為催化劑,先于正己烷溶劑中室溫反應(yīng)12小時(shí)。隨后,加入MgO與CH2Cl2,在40 oC下反應(yīng)3小時(shí),可以79%的收率得到聯(lián)烯環(huán)戊烯酮產(chǎn)物4,dr > 19:1(Method A)。
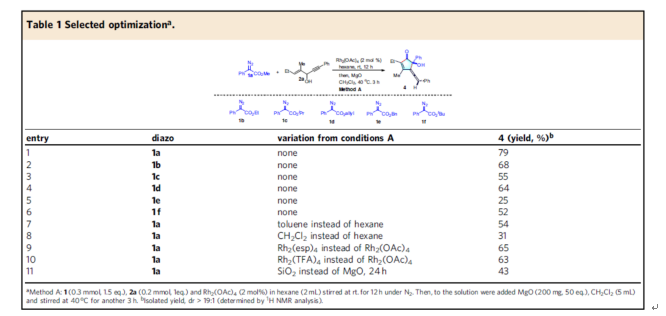
(圖片來(lái)源:Nat. Commun.)
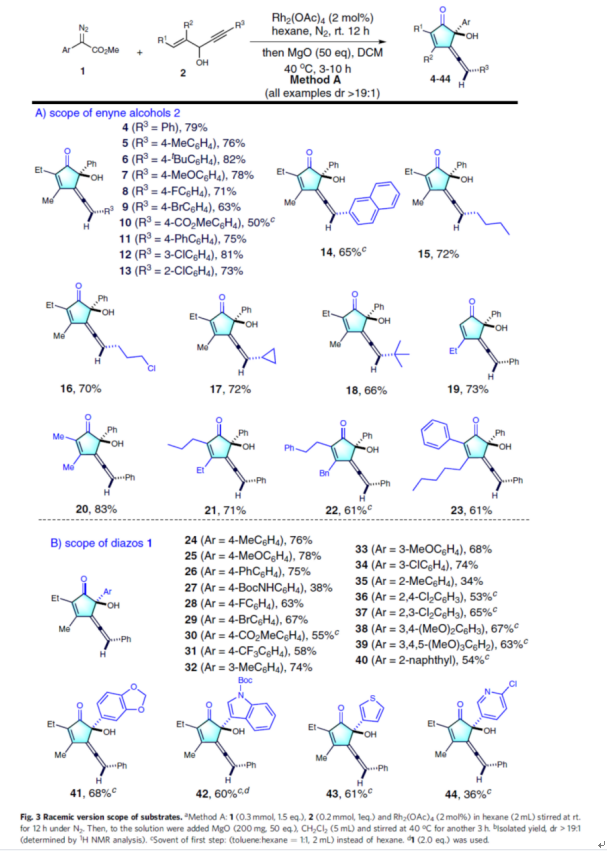
在獲得上述最佳反應(yīng)條件后,作者對(duì)底物范圍進(jìn)行了擴(kuò)展(Fig. 3)。首先,當(dāng)烯炔醇底物2的R3為不同電性取代的芳基、萘基、烷基時(shí),均可順利反應(yīng),獲得相應(yīng)的產(chǎn)物4-18,收率為50-82%。當(dāng)烯炔醇底物2的R1與R2為各種不同取代的烷基、苯基時(shí),均與體系兼容,獲得相應(yīng)的產(chǎn)物19-23,收率為61-83%。其次,當(dāng)重氮乙酸酯底物1中含有不同電性取代的芳基、萘基、雜芳基時(shí),均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物24-44,收率為34-78%。值得注意的是,上述所有過(guò)程均具有出色的非對(duì)映選擇性,即dr > 19:1。
(圖片來(lái)源:Nat. Commun.)
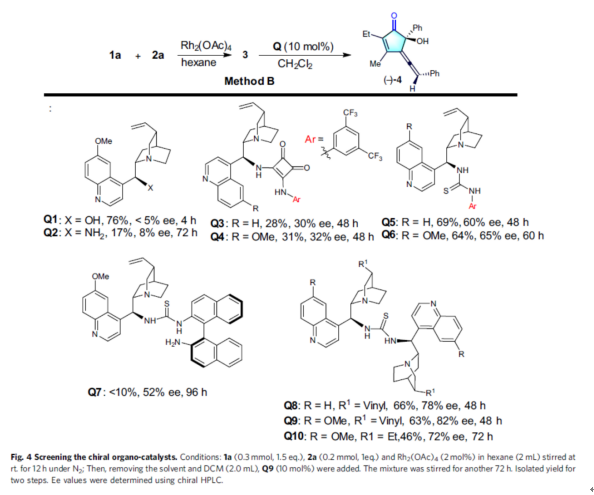
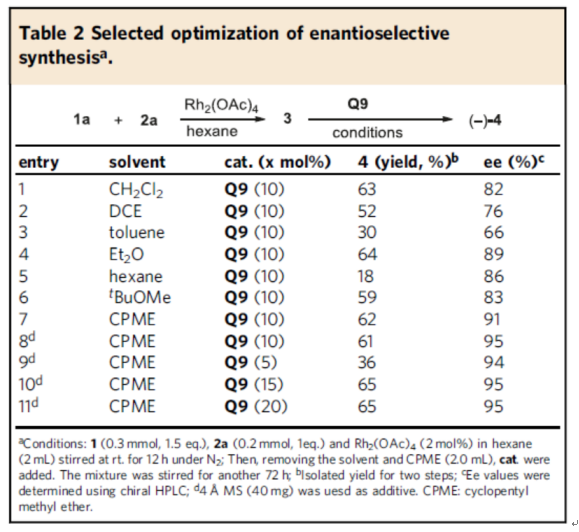
緊接著,作者對(duì)手性聯(lián)烯環(huán)戊烯酮4的對(duì)映選擇性合成條件進(jìn)行了優(yōu)化(Fig. 4)。優(yōu)化結(jié)果表明,當(dāng)以1a與2a作為底物,Rh2(OAc)4作為催化劑,正己烷作為溶劑,先于室溫下反應(yīng)12小時(shí)。隨后,去除溶劑后加入Q9作為有機(jī)催化劑,4? MS作為添加劑,在環(huán)戊基甲醚溶劑中反應(yīng),能以65%的收率獲得手性聯(lián)烯環(huán)戊烯酮4,ee為95%(Method B)。
(圖片來(lái)源:Nat. Commun.)
(圖片來(lái)源:Nat. Commun.)
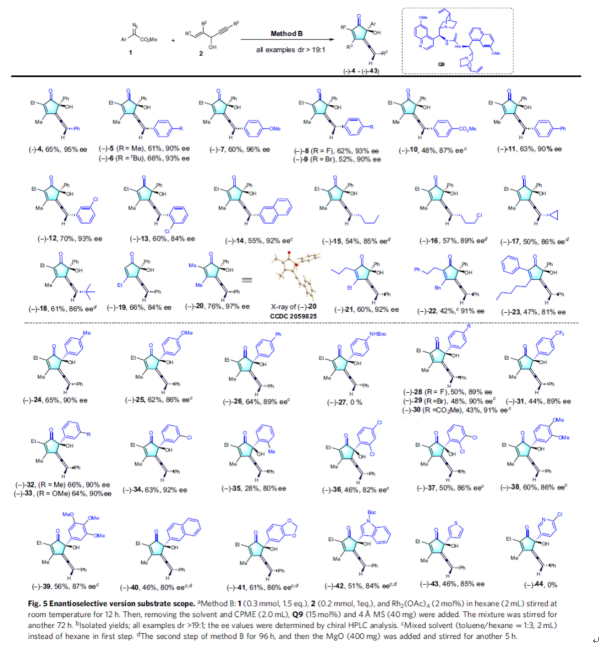
隨后,作者對(duì)不對(duì)稱(chēng)催化策略的底物范圍進(jìn)行了擴(kuò)展(Fig. 5)。首先,當(dāng)烯炔醇底物2的R3為不同電性取代的芳基、萘基、烷基時(shí),均可順利反應(yīng),獲得相應(yīng)的產(chǎn)物(-)-4-18,收率為48-70%,ee為84-96%。當(dāng)烯炔醇底物2的R1與R2為各種不同取代的烷基、苯基時(shí),均與體系兼容,獲得相應(yīng)的產(chǎn)物(-)-19-23,收率為42-76%,ee為81-97%。值得注意的是,空間位阻的增加導(dǎo)致產(chǎn)物的收率和對(duì)映選擇性降低。其次,當(dāng)重氮乙酸酯底物1中含有不同電性取代的芳基、萘基、雜芳基時(shí),均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物(-)-24-26和(-)-28-43,收率為28-66%,ee為80-92%。其中,使用鄰甲基取代的芳基重氮乙酸酯時(shí),由于空間位阻導(dǎo)致(-)-35的收率(28%)以及ee(80%)偏低。然而,在最佳條件下未能獲得產(chǎn)物(-)-27和(-)-44。
(圖片來(lái)源:Nat. Commun.)
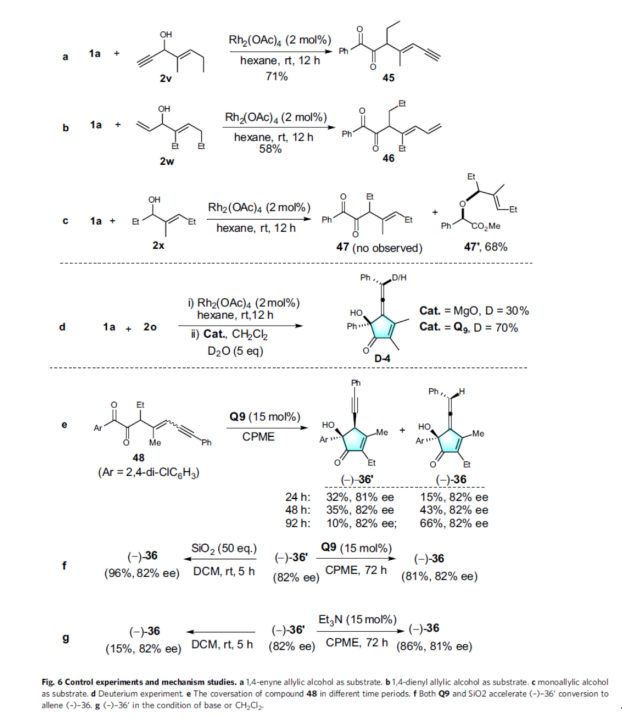
為了進(jìn)一步了解反應(yīng)的機(jī)理,作者還進(jìn)行了相關(guān)的實(shí)驗(yàn)研究(Fig. 6)。首先,在銠催化下,1a可分別與2v和2w反應(yīng),獲得相應(yīng)的1,2-二酮化合物45(收率71%)和46(收率58%)(Fig. 6a, b)。同時(shí),1a與2x反應(yīng)未能生成相應(yīng)的二酮 47,但以68%的收率獲得O-H插入產(chǎn)物47'(Fig. 6c)。上述結(jié)果表明,π-σ(C-OH)-π是醇的基本結(jié)構(gòu),可進(jìn)行串聯(lián)葉立德的形成/[2,3]-σ重排和逆向二苯乙醇酸重排的過(guò)程,從而生成1,2-二酮中間體。其次,在1a與2o的標(biāo)準(zhǔn)反應(yīng)體系中加入D2O時(shí),可分別獲得具有70%和30%氘標(biāo)記的D-4(Fig. 6d)。其中,Q9比MgO具有更好的氘標(biāo)記率,可能是由于Q9具有更高的穩(wěn)定中間陰離子的能力,從而表明從炔烴到聯(lián)烯的過(guò)程中發(fā)生了質(zhì)子轉(zhuǎn)移。此外,當(dāng)以二酮化合物48作為底物時(shí),經(jīng)對(duì)映選擇性環(huán)異構(gòu)化后,可同時(shí)獲得(-)-36?和(-)-36,且反應(yīng)的收率取決于反應(yīng)的時(shí)間(Fig. 6e)。同時(shí),(-)-36?在SiO2或有機(jī)催化劑Q9存在下反應(yīng),均以高收率獲得(-)-36,且對(duì)映選擇性保持不變(Fig. 6f)。事實(shí)上,在Et3N等堿存在下,炔烴到聯(lián)烯的異構(gòu)化也能順利進(jìn)行。即使沒(méi)有催化劑,當(dāng)在二氯甲烷溶劑中攪拌時(shí),(-)-36′的異構(gòu)化也可能發(fā)生(Fig. 6g)。
(圖片來(lái)源:Nat. Commun.)
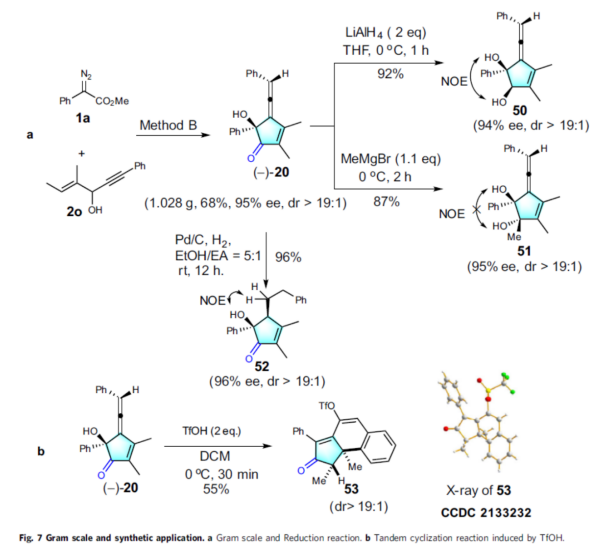
最后,作者對(duì)反應(yīng)的實(shí)用性進(jìn)行了研究(Fig. 7)。首先,克級(jí)規(guī)模實(shí)驗(yàn),同樣能夠以68%的收率得到產(chǎn)物(-)-20,ee為95%,dr > 19:1(Fig. 7a)。其次,(-)-20可進(jìn)行多種轉(zhuǎn)化。如(-)-20經(jīng)LiAlH4還原可獲得1,2-二醇化合物50,收率為92%,ee為94%。(-)-20與甲基格氏試劑反應(yīng),可獲得化合物51,收率為87%,ee為95%。(-)-20中的聯(lián)烯基可進(jìn)行選擇性氫化,獲得化合物52,收率為96%,ee為96%。有趣的是,(-)-20可與TfOH在二氯甲烷中的反應(yīng)生成外消旋的多環(huán)化合物53,收率為55%(Fig. 7b)。
(圖片來(lái)源:Nat. Commun.)
總結(jié):常州大學(xué)孫江濤與唐生表課題組報(bào)道了一種金屬-有機(jī)接力催化的策略,可通過(guò)1,4-烯炔醇與重氮化合物構(gòu)建具有高非對(duì)映和對(duì)映選擇性的手性聯(lián)烯環(huán)戊烯酮衍生物。其中,中間體烯炔二酮在不對(duì)稱(chēng)Nazarov環(huán)化反應(yīng)中起著關(guān)鍵的作用。
參考資料:https://mp.weixin.qq.com/s/4t2FBCc3qqxk-_DAigQVNQ
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話(huà):18676881059,郵箱:gongjian@huaxuejia.cn