



G蛋白偶聯(lián)受體(GPCRs)是真核生物中最大的一類膜蛋白,在感知胞外信號(hào)和介導(dǎo)胞內(nèi)信息轉(zhuǎn)導(dǎo)中發(fā)揮了重要作用,并參與調(diào)控多種生理過程,與人類疾病密切相關(guān),是最重要的藥物靶標(biāo)蛋白家族。GPCR與第二信使環(huán)磷酸腺苷相關(guān)的信號(hào)通路中,主要通過刺激型G蛋白(Gs)和抑制型G蛋白(Gi)來區(qū)分細(xì)胞內(nèi)不同的信號(hào)傳遞方式。了解受體對(duì)Gs和Gi信號(hào)通路的選擇性機(jī)制是GPCR和相關(guān)信號(hào)轉(zhuǎn)導(dǎo)領(lǐng)域長期以來的重要科學(xué)問題。
5-羥色胺(serotonin, 5-HT)是人體中樞神經(jīng)系統(tǒng)和周圍神經(jīng)系統(tǒng)的主要神經(jīng)遞質(zhì)之一,其通過結(jié)合5-羥色胺受體(5-HTR)發(fā)揮調(diào)控食欲、記憶、認(rèn)知,情緒調(diào)節(jié)和成癮等重要的生理過程,這也使5-羥色胺受體成為抑郁癥、精神分裂癥、偏頭痛等疾病的重要治療靶點(diǎn)。5-羥色胺受體家族是GPCR超家族中最復(fù)雜的亞家族之一,其包含12種亞型,不同亞型的受體在人體中發(fā)揮不同的生理功能,并且與不同種類的G蛋白偶聯(lián)。其中5-HT4、5-HT6和5-HT7受體主要偶聯(lián)下游Gs蛋白,5-HT1和5-HT5受體主要偶聯(lián)下游Gi蛋白。對(duì)于在同一內(nèi)源性配體5-HT激活后,不同亞型的5-羥色胺受體如何偏好地偶聯(lián)下游G蛋白來調(diào)控細(xì)胞應(yīng)答一直困擾著研究人員。
2022年6月16日,中科院上海藥物研究所徐華強(qiáng)研究員團(tuán)隊(duì),聯(lián)合浙江大學(xué)張巖教授團(tuán)隊(duì)以及丹麥哥本哈根大學(xué)David E. Gloriam教授團(tuán)隊(duì)等,經(jīng)歷一年投稿,在Molecular Cell雜志上在線發(fā)表了最新的研究成果“GPCRs steer Gi and Gs selectivity via TM5-TM6 switches as revealed by structures of serotonin receptors”,取得了5-羥色胺受體結(jié)構(gòu)和功能領(lǐng)域又一突破性進(jìn)展,成功解析了5-HT4、5-HT6、5-HT7受體與激活型G蛋白(Gs蛋白)和5-HT4受體與抑制型G蛋白(Gi蛋白)結(jié)合的復(fù)合物三維結(jié)構(gòu)。他們系統(tǒng)性地揭示了小分子配體5-HT和5-CT識(shí)別5-羥色胺受體亞型的結(jié)構(gòu)基礎(chǔ),并闡明了5-羥色胺受體選擇性偶聯(lián)Gs蛋白和Gi蛋白的分子機(jī)制。
聯(lián)合團(tuán)隊(duì)采用單顆粒冷凍電鏡技術(shù)分別對(duì)5-HT激活5-HT4、5-HT6形成的Gs復(fù)合物、5-CT激活5-HT7形成的Gs復(fù)合物和5-HT激活5-HT4形成的Gi復(fù)合物進(jìn)行了結(jié)構(gòu)重塑,最終解析了4個(gè)在配體激活狀態(tài)下與不同蛋白的復(fù)合物結(jié)構(gòu),其中5-HT-5-HT4-Gs復(fù)合物結(jié)構(gòu)的分辨率為3.1埃,5-HT-5-HT6-Gs復(fù)合物結(jié)構(gòu)的分辨率為3.3埃,5-CT-5-HT7-Gs復(fù)合物結(jié)構(gòu)的分辨率為3.2埃,5-HT-5-HT4-Gi復(fù)合物結(jié)構(gòu)的分辨率為3.2埃(圖1)。
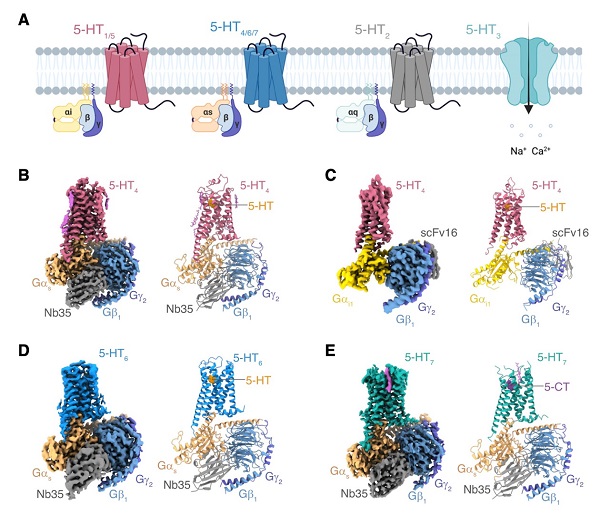
圖1. 5-HT4、5-HT6和5-HT7受體結(jié)構(gòu)
該團(tuán)隊(duì)將所獲的這三種Gs偶聯(lián)的5-羥色胺受體與Gi偶聯(lián)的5-羥色胺受體進(jìn)行了結(jié)構(gòu)比較,并進(jìn)一步與另外已發(fā)表的19種Gs和Gi偶聯(lián)的A類GPCRs結(jié)構(gòu)進(jìn)行比較。他們發(fā)現(xiàn),跨膜螺旋TM5和TM6長度作為“macro-switch”來分別確定受體對(duì)Gs和Gi的選擇性,且這種TM5-TM6 長度的“macro-switch”由A類GPCRs-G蛋白結(jié)構(gòu)共享。此外,TM5和TM6中的特定殘基充當(dāng)“micro-switches”以與Gs或Gi形成特定的相互作用。這些結(jié)果展示了A類GPCRs的 Gs和Gi蛋白偶聯(lián)選擇性或混雜的共同機(jī)制(圖2)。
為探究G蛋白偏好5-羥色胺受體的假設(shè),該團(tuán)隊(duì)進(jìn)行了兩組實(shí)驗(yàn)來檢驗(yàn)TM5和TM6的長度是GPCR區(qū)分Gs和Gi蛋白的關(guān)鍵因素的假設(shè)。第一組實(shí)驗(yàn)是將5-HT1A受體的TM6末端螺旋斷裂并且TM5螺旋延伸或5-HT4、5-HT7受體的TM5末端螺旋斷裂并且TM6螺旋延伸,功能結(jié)果表明這種改造影響了5-HT4、5-HT7受體偶聯(lián)Gs蛋白的能力,然后將5-HT1A受體由原來Gi偶聯(lián)轉(zhuǎn)變成了Gs偶聯(lián),這些結(jié)果支持TM5和TM6長度的“macro-switch”是G蛋白選擇性的關(guān)鍵。第二組實(shí)驗(yàn)是將Gi偶聯(lián)的5-HT1A的TM5-TM6區(qū)域與Gs偶聯(lián)的5-HT4和5-HT7受體的TM5-TM6區(qū)域互換。研究結(jié)果表明,嵌合受體5-HT1A (5-HT4_P5.50-P6.50)與野生型5-HT4具有相似的功能,即具有高組成型激活且?guī)缀醪皇芘潴w調(diào)節(jié)。同樣,5-HT1A (5-HT7_P5.50-P6.50)顯示出與野生型5-HT7相似的功能,在激動(dòng)劑誘導(dǎo)下進(jìn)行的cAMP 積累。如果將5-HT4和5-HT7的ICL3替換為5-HT1A,在激動(dòng)劑誘導(dǎo)下進(jìn)行的cAMP積累的能力幾乎喪失,類似于野生型5-HT1A受體。綜上所述,該團(tuán)隊(duì)以5-羥色胺家族受體為切入點(diǎn)揭示了A類GPCRs的Gs、Gi蛋白偶聯(lián)選擇性機(jī)制,并擴(kuò)展了5-羥色胺受體的配體識(shí)別基礎(chǔ)。
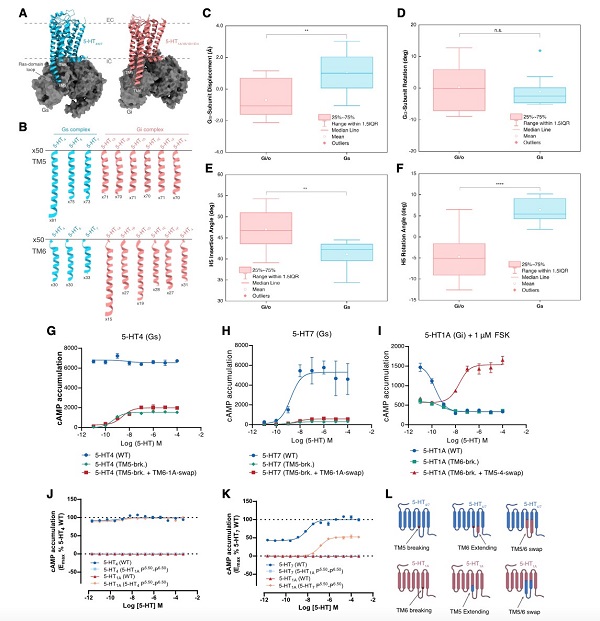
圖2. 5-羥色胺受體TM5、TM6對(duì)G蛋白選擇性偶聯(lián)的影響
徐華強(qiáng)團(tuán)隊(duì)長期致力于5-羥色胺家族受體的結(jié)構(gòu)與功能研究,并取得了一系列系統(tǒng)性的重要成果。2013年,該團(tuán)隊(duì)于在Science上首次報(bào)導(dǎo)了激動(dòng)劑結(jié)合的5-HT1B受體的高分辨率晶體結(jié)構(gòu)1。2018年,該團(tuán)隊(duì)在Cell Discovery發(fā)表了首個(gè)反向激動(dòng)劑結(jié)合的5-HT1B受體的晶體結(jié)構(gòu)2。2021年3月,該團(tuán)隊(duì)在Nature上首次報(bào)道了5-HT1A、5-HT1D、5-HT1E受體的結(jié)構(gòu),并揭示了磷脂PI4P(PtdIns4P)和膽固醇調(diào)節(jié)受體功能的機(jī)制和受體的本底激活機(jī)制3。2021年7月,該團(tuán)隊(duì)在Cell Research上首次報(bào)道了5-HT1F受體的結(jié)構(gòu),并揭示了偏頭痛藥物拉米替坦對(duì)該受體的選擇性結(jié)合機(jī)制4。2022年5月,該團(tuán)隊(duì)在Cell Discovery上首次報(bào)道了5-HT5A受體的結(jié)構(gòu)5。
在前期研究基礎(chǔ)上,該成果不僅揭示了A類GPCR選擇性偶聯(lián)G蛋白的分子機(jī)制,還填補(bǔ)了5-HT家族受體結(jié)構(gòu)解析的最后空白。該成果首次報(bào)道5-HT4、5-HT6、5-HT7受體結(jié)構(gòu),使所有12種5-HT受體亞型的結(jié)構(gòu)均得到了解析。這些在5-羥色胺受體上系統(tǒng)性的研究極大地豐富我們對(duì)5-羥色胺系統(tǒng)的結(jié)構(gòu)與功能認(rèn)識(shí),并為開發(fā)治療抑郁癥、精神分裂癥、偏頭痛等疾病的藥物提供了重要基礎(chǔ)。
本課題由徐華強(qiáng)研究員領(lǐng)銜,聯(lián)合浙江大學(xué)張巖教授和丹麥哥本哈根大學(xué)的David E. Gloriam教授團(tuán)隊(duì)等,精誠合作,全力攻關(guān),并在中國科學(xué)院上海藥物研究所蔣軼研究員和余學(xué)奎研究員的協(xié)助下完成。上海藥物研究所黃思婕博士和徐沛雨博士、浙江大學(xué)基礎(chǔ)醫(yī)學(xué)院研究助理沈丹丹和丹麥哥本哈根大學(xué)的Icaro A. Simon為本文共同第一作者。
參考文獻(xiàn):
1.Wang, C. et al. Structural basis for molecular recognition at serotonin receptors. Science 340, 610-614 (2013).
2.Yin, W. et al. Crystal structure of the human 5-HT1B serotonin receptor bound to an inverse agonist. Cell discovery 4, 1-13 (2018).
3.Xu, P. et al. Structural insights into the lipid and ligand regulation of serotonin receptors. Nature 592, 469-473 (2021).
4.Huang, S. et al. Structural basis for recognition of anti-migraine drug lasmiditan by the serotonin receptor 5-HT1F–G protein complex. Cell Research 31, 1036-1038 (2021).
5.Tan, Y. et al. Structural insights into the ligand binding and Gi coupling of serotonin receptor 5-HT5A. Cell discovery 8, 1-9 (2022).
文章鏈接:https://www.sciencedirect.com/science/article/pii/S1097276522005299?dgcid=coauthor
參考資料:http://www.simm.cas.cn/web/xwzx/kydt/202206/t20220617_6462601.html
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn