


在循環腫瘤細胞真正抵達并定植于潛在轉移風險的遠端臟器組織之前,原位腫瘤分泌腫瘤相關分泌因子(TDSF)誘導轉移前微環境的發展形成。轉移前微環境對于腫瘤轉移的發生發展至關重要,假若能阻止轉移前微環境的形成,是否就能夠做到“釜底抽薪”,控制甚至預防腫瘤轉移的發生?
研究團隊在成功構建腫瘤轉移前微環境動物模型的基礎上,記錄了在肺轉移前微環境發展過程中,基質微環境和免疫微環境兩大方面的動態病理進程,主要包括:成纖維細胞激活、胞外基質成分沉積、血管新生及通透性提高、骨髓來源的免疫抑制性細胞(MDSC)募集并發揮免疫抑制性功能等。
基于轉移前微環境的病理特征,研究團隊設計構建了轉移前微環境響應性后組裝多肽分子FR17,并通過多種技術手段考察了該多肽分子在轉移前微環境定點后組裝形成的薄膜毯狀納米結構—作者將其命名為“多肽納米毯”。
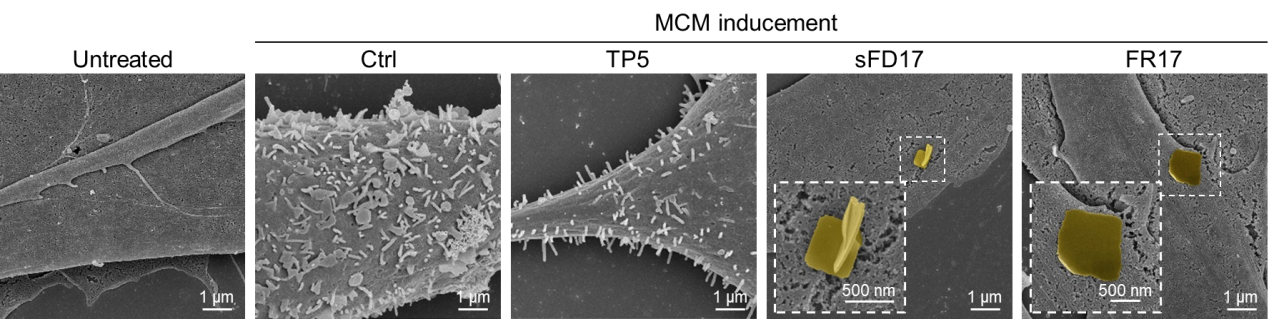
圖1. 多肽FR17在腫瘤上清液刺激后響應性自組裝形成“多肽納米毯”,抑制成纖維細胞的激活
機制研究揭示了響應性后組裝形成的“多肽納米毯”通過抑制轉移前微環境早期形成過程中成纖維細胞的激活,抑制促轉移基質微環境的發展形成;遏止基質重塑、血管新生和滲漏過程;抑制MDSC遷移趨化,降低了MDSC的募集比例,改善了免疫抑制性微環境。
在黑色素瘤肺轉移模型以及原位腫瘤切除術后復發和轉移模型中,多肽FR17均表現出良好的抗轉移效果。研究結果證明,響應性后組裝“多肽納米毯”通過對轉移前微環境發展形成過程的干預,能夠有效降低腫瘤轉移風險。
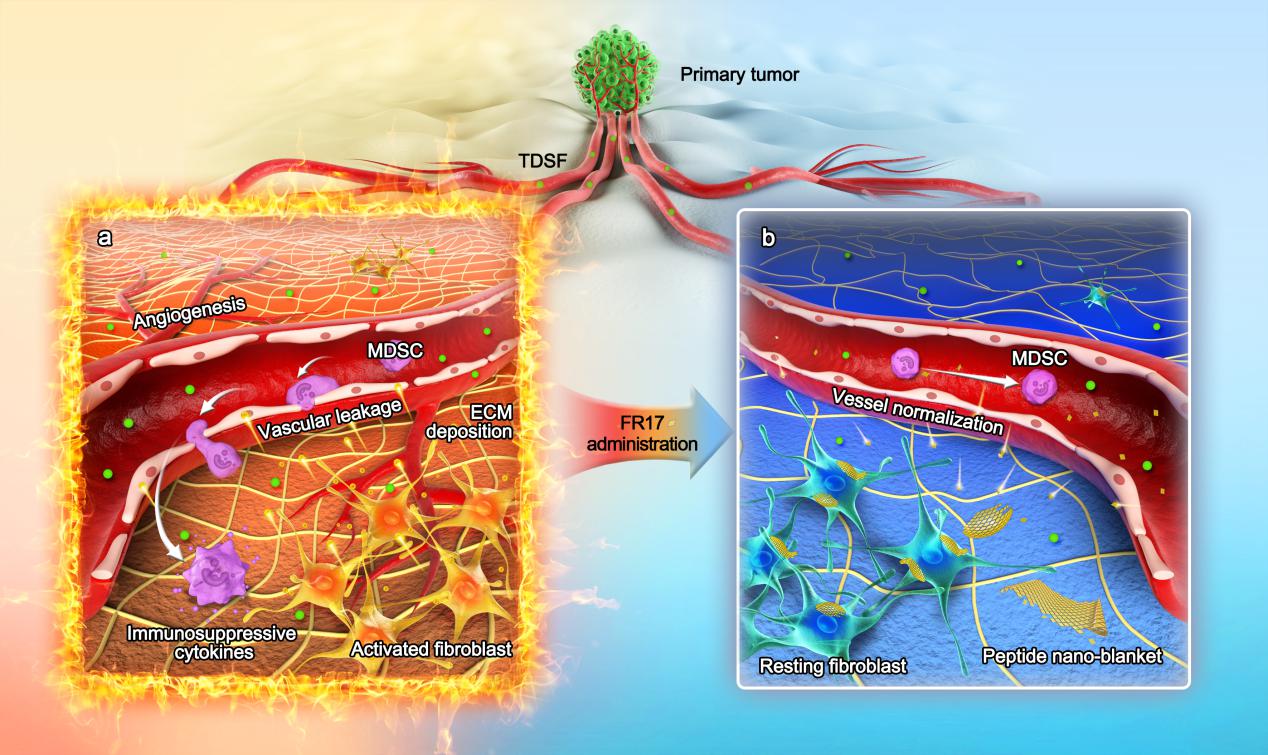
圖2.論文示意圖:“多肽納米毯”通過抑制成纖維細胞的激活,遏制轉移前微環境的發展形成
該研究設計構建了轉移前微環境響應性后組裝多肽FR17,并證明FR17在體后組裝形成的“多肽納米毯”通過抑制成纖維細胞激活調控轉移前微環境的形成,實現了腫瘤轉移的有效防治,為抗腫瘤轉移多肽藥物遞送提供了一種自身具有微環境調控能力的響應性后組裝功能性載體平臺。
該研究論文的第一作者為浙江大學藥學院博士生周熠,通訊作者為浙江大學藥學院高建青教授和韓旻副教授。
原文鏈接:https://www.nature.com/articles/s41467-022-30634-8.
參考資料:http://www.cps.zju.edu.cn/2022/0530/c58891a2568614/page.htm
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn