

鮑曼不動桿菌可導致急性肺炎、腦膜炎、敗血癥等嚴重疾病,其耐藥率逐年上升,已引起臨床醫生和微生物學者的嚴重關注。2017年,世界衛生組織發布了迫切需要新型抗生素的細菌清單,耐碳青霉烯類的鮑曼不動桿菌位列最高迫切等級“極為重要”的第一位,這足以說明鮑曼不動桿菌對人類健康構成的重大威脅。目前,臨床治療鮑曼不動桿菌感染的主要方法是抗生素治療或聯合用藥治療。但隨著抗生素的使用,多重廣泛耐藥型鮑曼不動桿菌會更加在世界范圍內傳播,導致對鮑曼不動桿菌感染的治療愈發困難。上述這些問題使抗鮑曼不動桿菌藥物研究顯得迫在眉睫。
細菌細胞壁多糖類成分如脂多糖(LPS)或莢膜多糖(CPS)是其重要毒力因子,也是發展糖類抗菌藥物、疫苗或診斷劑的源頭。利用化學合成手段制備這些糖鏈,可獲得結構明確、均一的糖分子,再通過免疫學研究可以明確糖-免疫活性間的關系,從而為抗菌糖類疫苗的研究提供依據。鮑曼不動桿菌LPS內核心區域具有高度的結構特異性,使其成為開發抗鮑曼不動桿菌藥物或疫苗的重要潛在靶點。近日,我院楊勁松教授和江南大學尹健教授合作,完成了來自鮑曼不動桿菌ATCC 17904菌株LPS內核心的四種寡糖片段的首次合成和抗原性評價。

目標寡糖富含Kdo糖殘基,其合成極具挑戰性:1)Kdo糖苷鍵的立體選擇性構建是糖合成中的難點;2)寡糖1-3具有4,5-二取代結構,C4和C5位取代的Kdo糖殘基所施加的空間位阻,使這類分支糖的組裝非常困難。
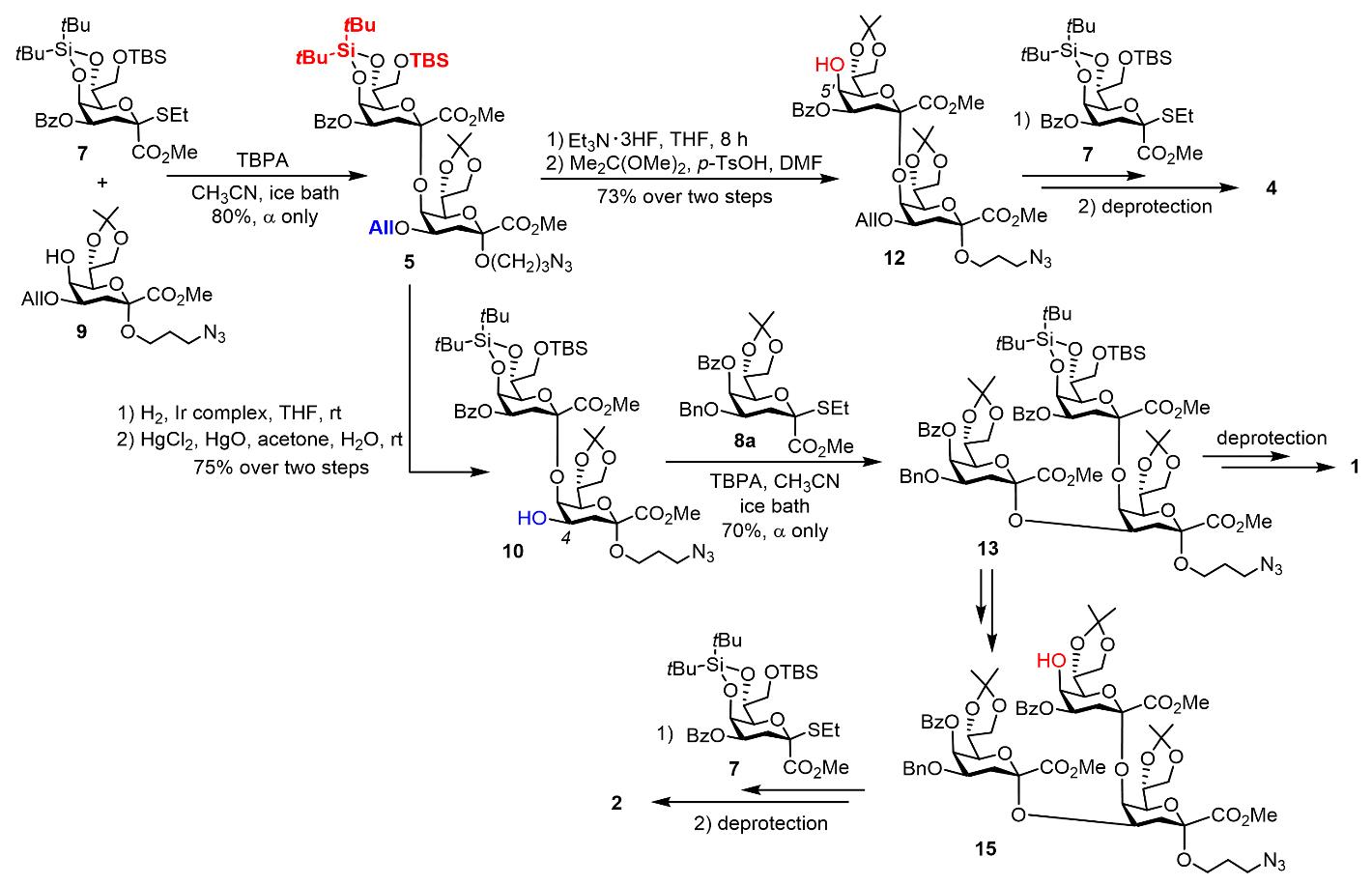
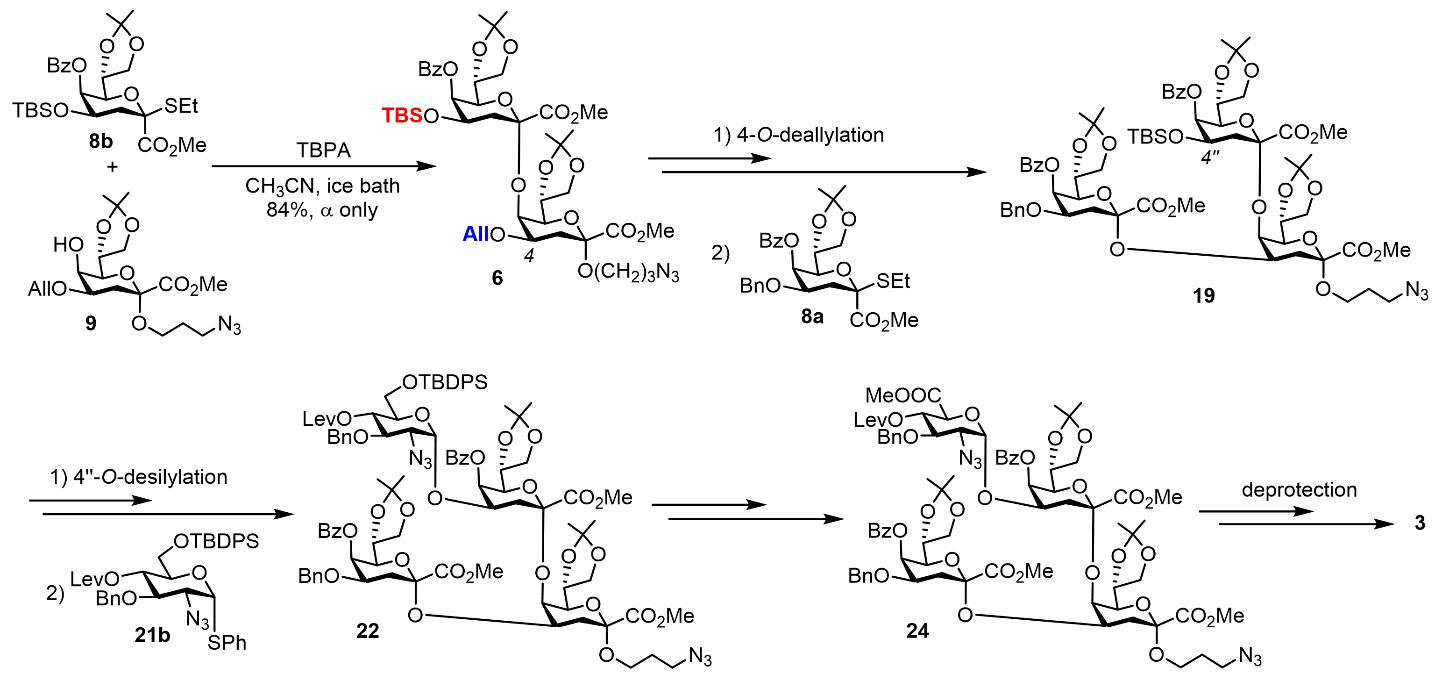
從2014年開始,楊勁松課題組系統研究了保護基對Kdo糖基供體糖苷化反應立體選擇性的影響,發展出兩類優勢Kdo糖基供體:5,7-O-二叔丁基亞甲硅基保護的Kdo乙硫苷供體7(Yang, J.-S., et al, Angew. Chem. Int. Ed. 2015, 54, 10894)和5-O-苯甲酰基保護的Kdo乙硫苷供體8a,b(Yang, J.-S., et al, J. Am. Chem. Soc. 2018, 140, 3574),這兩類供體能夠精準完成Kdo糖苷鍵的構建。在本研究中,他們建立了一種柔性的發散性策略實現了目標寡糖的合成。首先在三(4-溴苯基)六氯銻酸銨(TBPA)活化下,將Kdo供體7和8b分別與Kdo單糖受體9糖苷化連接生成二糖5和6。二糖5的C4、C5’/7’和C8’位以及6的C4和C4’位的保護基具有正交性,能夠被選擇性脫除,從而裸露某一位置的羥基以實現糖鏈的延長。合成過程中,供體7和8a,b所參與的糖苷化反應能立體專一地生成α-構型的Kdo糖苷產物,而收率取決于受體結構的復雜程度;另外,對于4,5-二取代的Kdo結構,他們采取了先(2→5)連接再(2→4)連接的次序,順利實現分支糖骨架的組裝。
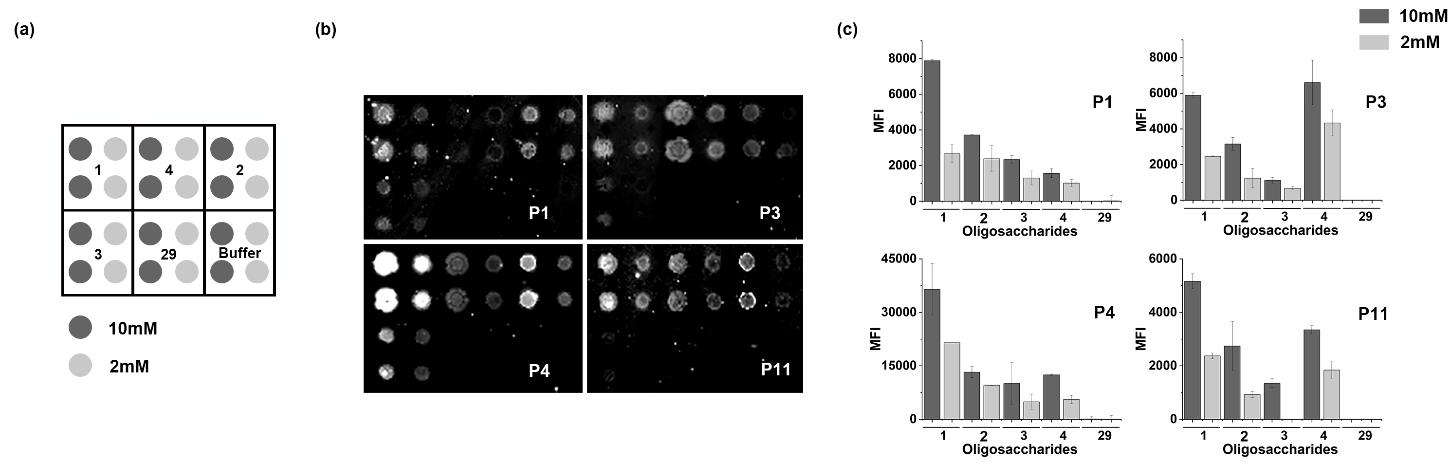
隨后,合作者尹健課題組利用糖芯片技術檢測了合成的寡糖與鮑曼不動桿菌感染患者血清抗體的相互作用。結果表明,4,5-分支的Kdo三聚糖1與患者血清IgG抗體的結合能力最強,很可能是鮑曼不動桿菌LPS的關鍵抗原表位,具有用于開發診斷劑和抗菌疫苗的潛力。
這一研究成果最近在線發表于Angew. Chem. Int. Ed. 2022, e202204420 (hot paper) (https://doi.org/10.1002/anie.202204420),博士生周先洋是該工作的主要完成人。
以上研究工作受到國家自然科學基金委和科技部的大力資助。
參考資料:https://pharmacy.scu.edu.cn/info/1033/4673.htm
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn