

細胞作為生物體生命活動的基本單元,為了不被干擾地同時進行多種復雜的生化反應,演化出許多膜包被的細胞器——如細胞核、內質網、高爾基體、線粒體等——對異質性的生化過程進行區塊化的分隔,保證不同的反應在特定的區域內高效、有序地完成。除了膜包被的細胞器外,還存在一類無膜包被或者半膜包被的可以富集生物大分子的結構,例如核仁、應激顆粒(Stress granule),以及神經元中的突觸后致密區(postsynaptic density, PSD)等1–3。近年來,這些結構的形成原理和功能在科學界引起了極大的關注,人們發現這類結構一般是通過蛋白-蛋白或蛋白-RNA相互作用形成液–液相分離(Liquid-liquid phase separation, LLPS)產生的。LLPS主要以不同蛋白結構域、蛋白內在無序區(intrinsic disordered region)以及蛋白-RNA間形成的多價相互作用為驅動力而發生2。無膜或半膜細胞器在細胞中發揮重要的功能,相比于傳統的膜包被的細胞器,它們可以更高效地與外界環境發生物質交換,同時保障結構內的物質在細胞內處于相對獨立的空間,其組成與濃度可以被精確調控。目前,針對LLPS在生理及病理狀態下的功能研究已取得諸多突破性成果,LLPS已被證明在基因表達調控4、細胞對外在環境的壓力響應5、先天免疫應答6、神經退行性疾病的發生7等方面均發揮重要作用。基于這些成果,對液–液相分離過程的精準時空調控及其分子機制的研究也方興未艾。
蛋白的翻譯后修飾(post-translational modifications, PTMs)可以通過改變氨基酸殘基間的相互作用強度實現對液-液相分離體系的動態調控8。例如,精氨酸甲基化修飾通過減弱其與芳香氨基酸間的相互作用抑制Ddx4、hnRNPA2、FUS和FMRP等蛋白形成LLPS9–13;磷酸化修飾可以在不同的相分離體系起到截然相反的調控作用,如Tau7和FMRP14蛋白的磷酸化修飾促進其發生LLPS,而FUS和TDP-43的LLPS過程受磷酸化修飾抑制15,16。
盡管多種翻譯后修飾已被闡明可以參與LLPS的調控,糖基化修飾——一種廣泛存在于高等生物細胞中的翻譯后修飾——對LLPS的調控作用卻始終未被系統研究和闡釋。O-GlcNAc修飾是存在于胞內蛋白絲氨酸和蘇氨酸殘基上的糖基化修飾,在哺乳動物大腦中廣泛分布,其修飾酶OGT在興奮性神經元PSD中大量富集17,18。北京大學化學與分子工程學院、北大-清華生命科學聯合中心陳興課題組一直致力于解析糖基化修飾在不同器官與組織中的分布和生物學功能。他們發現,PSD的重要組成蛋白SynGAP具有多個O-GlcNAc修飾位點。此前,香港科技大學(現南方科技大學)的張明杰課題組發現,SynGAP與PSD中的腳手架蛋白PSD-95所形成的復合物可發生液-液相分離,且該LLPS過程對于PSD的形成和功能具有重要意義19,20。基于此,陳興課題組與北京大學藥學院董甦偉課題組、張明杰課題組等合作,利用化學半合成策略構建了特定位點具有O-GlcNAc修飾的SynGAP蛋白,闡明了O-GlcNAc修飾對SynGAP/PSD95液–液相分離過程的調控和分子機制,相關成果以“O-GlcNAcylation modulates liquid–liquid phase separation of SynGAP/PSD-95”為題于2022年5月30日發表在Nature Chemistry雜志。

在所鑒定到的眾多O-GlcNAc修飾位點中,他們選定了位于SynGAP蛋白CC-PBM結構域1159位絲氨酸(S1159)與1306位蘇氨酸(T1306)兩個位點進行深入研究,因為CC-PBM結構域通過與PSD-95蛋白PSG結構域的相互作用形成LLPS(圖1a)。利用表達蛋白連接(expressed protein ligation, EPL)策略,他們合成了S1159與T1306位點特異O-GlcNAc修飾的SynGAP CC-PBM蛋白(SynGAP-S1159OG & SynGAP-T1306OG,圖1b)。接著,通過液滴成像實驗與沉淀離心實驗,證明了SynGAP-T1306OG可以完全抑制LLPS形成(圖1c)。結合同源結構模擬與體積排阻-靜態光散射分析,他們提出SynGAP蛋白T1306位點的O-GlcNAc修飾通過阻礙T1306與PSD-95蛋白369位組氨酸(H369)間形成氫鍵,破壞蛋白相互作用進而阻礙LLPS形成,并在細胞內驗證了該機理(圖1d-e)。

圖1 SynGAP蛋白O-GlcNAc位點鑒定,蛋白合成與抑制LLPS機理
O-GlcNAc修飾通常是亞化學計量,即修飾率不足100%。那么,亞化學計量的O-GlcNAc修飾能否有效地調控LLPS便是一個重要的問題。他們通過調整合成蛋白中O-GlcNAc修飾比例,模擬不同修飾率對LLPS的影響,結果顯示不同修飾率(10% ~ 100%)均可以對LLPS產生不同程度的抑制。同時,與通過降低蛋白濃度抑制LLPS的方式相比,等比例的O-GlcNAc修飾對LLPS具有更明顯的抑制效果,即O-GlcNAc對于LLPS的抑制呈現出顯性負調控(dominant-negative effect)的特征(圖2a-b)。此外,O-GlcNAc修飾對LLPS的抑制是動態可逆的,通過加入O-GlcNAc轉移酶OGT或去修飾酶OGA可以動態地調節O-GlcNAc水平與LLPS閾值(圖2c)。
陳興課題組長期致力于糖化學和糖生物學研究,神經系統中的蛋白質糖基鑒定與功能研究是目前的重點方向之一。本工作利用化學半合成策略與多種技術手段,詳細闡明了特定位點O-GlcNAc修飾對SynGAP/PSD-95液–液相分離的調控作用,揭示了O-GlcNAc修飾在該體系中顯性負調控的作用方式和抑制LLPS發生的分子機制,證明了OGT/OGA對該過程的動態調控。該發現為詮釋O-GlcNAc修飾在調控神經系統發育與突觸可塑性等過程中的重要功能提供一個新的機制。同時,O-GlcNAc修飾可能作為一種普適性的調控機制,調控多種液–液相分離過程。
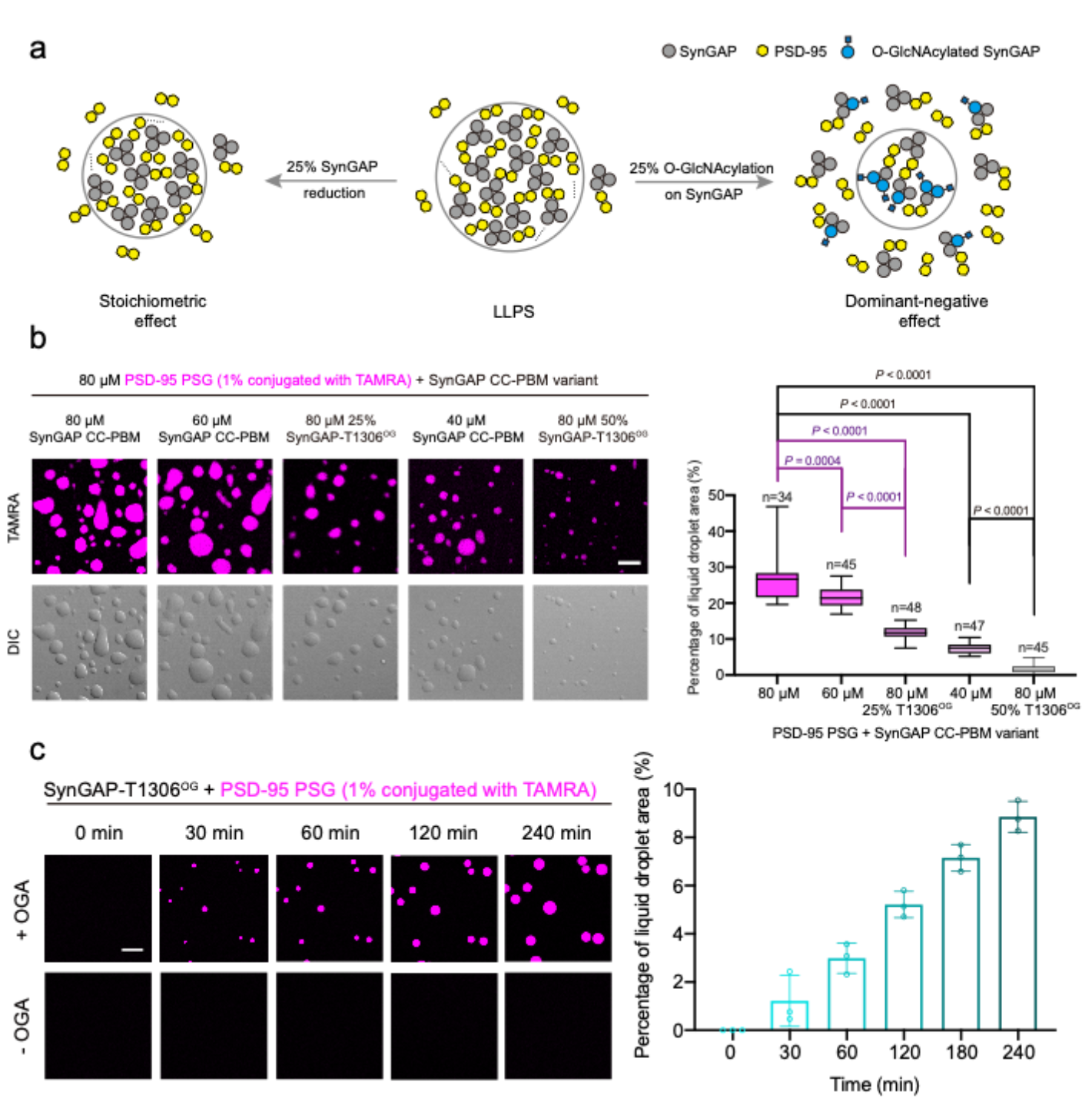
圖2 O-GlcNAc修飾對LLPS的顯性負調控與OGA動態調控
北京大學化學與分子工程學院、北大清華生命科學聯合中心的陳興教授和北京大學藥學院、天然藥物及仿生藥物國家重點實驗室董甦偉教授為本論文的共同通訊作者,生命科學聯合中心已畢業博士生呂品歐、杜逸飛和北京大學藥學院已畢業博士生賀長棟為論文的共同第一作者。南方科技大學生命科學學院張明杰課題組、北京大學生命科學學院李沉簡教授和化學與分子工程學院鄒鵬課題組參與了該研究工作。該研究工作得到了國家自然科學基金委、科技部、北大-清華生命科學聯合中心和北京分子科學國家研究中心的資助。
原文連接:https://doi.org/10.1038/s41557-022-00946-9
參考文獻:
1. Shin, Y. & Brangwynne, C. P. Liquid phase condensation in cell physiology and disease. Science 357, eaaf4382 (2017).
2. Banani, S. F., Lee, H. O., Hyman, A. A. & Rosen, M. K. Biomolecular condensates: organizers of cellular biochemistry. Nat. Rev. Mol. Cell Biol. 18, 285–298 (2017).
3. Chen, X., Wu, X., Wu, H. & Zhang, M. Phase separation at the synapse. Nat. Neurosci. 23, 301–310 (2020).
4. Sabari, B. R. et al. Coactivator condensation at super-enhancers links phase separation and gene control. Science 361, eaar3958-17 (2018).
5. Molliex, A. et al. Phase Separation by Low Complexity Domains Promotes Stress Granule Assembly and Drives Pathological Fibrillization. Cell 163, 123–133 (2015).
6. Du, M. & Chen, Z. J. DNA-induced liquid phase condensation of cGAS activates innate immune signaling. Science 361, 704–709 (2018).
7. Ambadipudi, S., Biernat, J., Riedel, D., Mandelkow, E. & Zweckstetter, M. Liquid–liquid phase separation of the microtubule-binding repeats of the Alzheimer-related protein Tau. Nat. Commun. 8, 275 (2017).
8. Hofweber, M. & Dormann, D. Friend or foe-Post-translational modifications as regulators of phase separation and RNP granule dynamics. J. Biol. Chem. 294, 7137–7150 (2019).
9. Nott, T. J. et al. Phase Transition of a Disordered Nuage Protein Generates Environmentally Responsive Membraneless Organelles. Mol. Cell 57, 936–947 (2015).
10. Qamar, S. et al. FUS Phase Separation Is Modulated by a Molecular Chaperone and Methylation of Arginine Cation-π Interactions. Cell 173, 720-734.e15 (2018).
11. Hofweber, M. et al. Phase Separation of FUS Is Suppressed by Its Nuclear Import Receptor and Arginine Methylation. Cell 173, 706-719.e13 (2018).
12. Ryan, V. H. et al. Mechanistic View of hnRNPA2 Low-Complexity Domain Structure, Interactions, and Phase Separation Altered by Mutation and Arginine Methylation. Mol. Cell 69, 465-479.e7 (2018).
13. Tsang, B. et al. Phosphoregulated FMRP phase separation models activity-dependent translation through bidirectional control of mRNA granule formation. Proc. Natl. Acad. Sci. U.S.A. 116, 4218–4227 (2019).
14. Kim, T. H. et al. Phospho-dependent phase separation of FMRP and CAPRIN1 recapitulates regulation of translation and deadenylation. Science 365, 825–829 (2019).
15. Murray, D. T. et al. Structure of FUS Protein Fibrils and Its Relevance to Self-Assembly and Phase Separation of Low-Complexity Domains. Cell 171, 615-627.e16 (2017).
16. Wang, A. et al. A single N‐terminal phosphomimic disrupts TDP‐43 polymerization, phase separation, and RNA splicing. Embo J 37, e97452 (2018).
17. Lagerlof, O. & Hart, G. W. O-GlcNAcylation of Neuronal Proteins: Roles in Neuronal Functions and in Neurodegeneration. in Glycobiology of the Nervous System vol. 9 343–366 (Glycobiology of the Nervous System, 2014).
18. Lagerlof, O., Hart, G. W. & Huganir, R. L. O-GlcNAc transferase regulates excitatory synapse maturity. Proc. Natl. Acad. Sci. U.S.A. 114, 1684–1689 (2017).
19. Zeng, M. et al. Phase Transition in Postsynaptic Densities Underlies Formation of Synaptic Complexes and Synaptic Plasticity. Cell 166, 1163-1175.e12 (2016).
20. Zeng, M. et al. Reconstituted Postsynaptic Density as a Molecular Platform for Understanding Synapse Formation and Plasticity. Cell 174, 1172-1187.e16 (2018).
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn