

近日,北京大學化學與分子工程學院應用化學系劉志博課題組在Journal of the American Chemical Society上發表題為“Radiotherapy Reduces N-Oxides for Prodrug Activation in Tumors”的研究論文。該研究發現,臨床放療劑量的核輻射能夠在試管、活細胞和活體腫瘤中將氮氧化物(N-oxide)高效還原為對應的三級芳香胺或芳香雜環化合物。作者利用該反應,成功實現了放療驅動的腫瘤選擇性氮氧化物前藥激活。
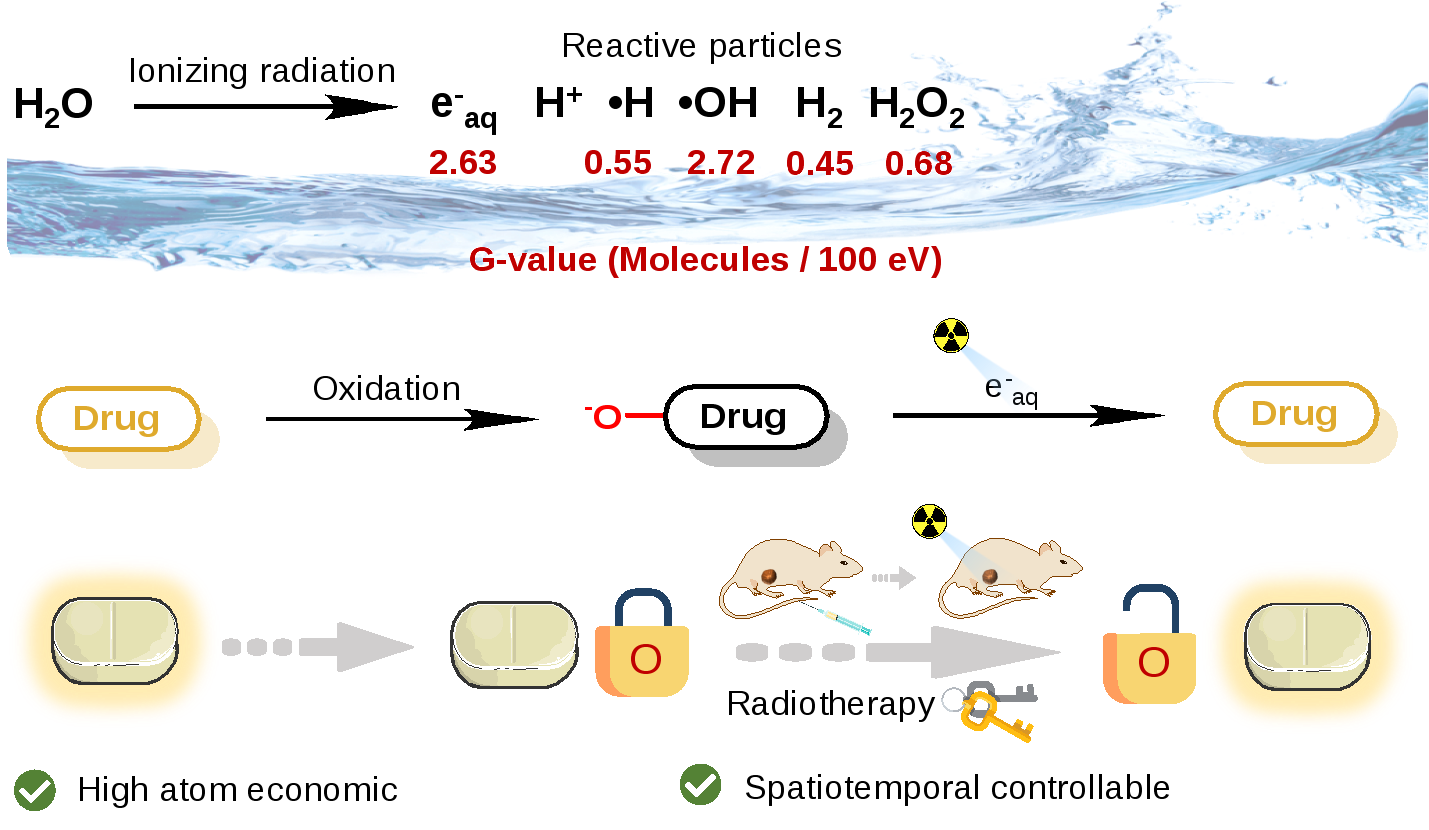
圖1. 放療射線還原氮氧化物實現腫瘤選擇性前藥激活
在臨床中,聯合放化療是超過50%癌癥病人的一線治療方案。但是,受限于傳統化療藥物較強的毒副作用,治療效果有待提高。發展腫瘤選擇性的化療前藥激活策略是解決上述問題的關鍵,同時也是藥物研發領域一個長期存在的挑戰。與其它激活手段相比,核輻射(如X射線、伽馬射線等)能夠精確地穿透深層組織,具有高時空分辨的優勢,臨床相關性也很強。水輻射分解可以產生多種活性化學物種,其中產額最高的是羥基自由基和水合電子。在2020年,劉志博課題組首次報道了核輻活體剪切化學(Angew Chem Int Ed, 2020, 59, 21546),該工作是基于羥基自由基的原位氧化反應。隨后,愛丁堡大學的Bradley課題組在2021年報道了基于氫自由基的輻射剪切化學(Nat Chem, 2021, 13, 805)。然而腫瘤的乏氧和還原性環境中水合電子的產額增加,發展水合電子介導的活體化學有利于提高前藥激活的效率。
首先,作者發現輻射產生的水合電子能夠在試管和活細胞環境中還原氮氧化物為對應的三級胺。隨后,作者設計并合成了不同結構類型的氮氧化物,包括芳香三級胺類、芳香雜環類、烷基類,發現該反應適用于具有較大共軛結構的芳香胺和芳香雜環氮氧化物結構,并通過理論計算對反應的機理進行了合理的預測。綜合考慮到芳香氮雜環是多種藥物的活性中心,作者設計并合成了一系列氮氧化藥物,這類氮氧化前藥只有一個氧原子即可屏蔽其活性,具有高原子經濟性,并能夠被放療射線還原為原藥。其中,抗腫瘤藥物喜樹堿(CPT)的氮氧化物被選擇作為模型前藥,在活細胞和活體中證明了放療射線能夠精準激活化療前藥,有效地抑制腫瘤生長,實現放療驅動的放化療聯合治療。綜上,該工作開發了新型的活體反應化學工具,發展了化療藥物的精確釋放策略,有望對腫瘤的放化聯合治療帶來關鍵性突破。
北京大學化學與分子工程學院的博士后丁澤軒為該文的第一作者,劉志博研究員為通訊作者。該工作得到了國家自然科學基金委、科技部、北京市重點研發專題、李革-趙寧生命科學青年研究基金、昌平實驗室、北京分子科學國家研究中心、化學與分子工程學院以及北大-清華生命科學聯合中心的資助。
原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.2c02521
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn