- 首頁
- 資訊
南開大學朱守非課題組Angew:銅催化α-甲硅烷基卡賓的不對稱B-H鍵插入反應合成手性烯丙基偕-甲硅烷基硼烷衍生物
來源:化學加原創 2022-05-03
導讀:近日,南開大學化學學院朱守非課題組開發了銅(I)/手性雙噁唑啉絡合物催化以1-甲硅烷基環丙烯為前體的α-甲硅烷基α-乙烯基卡賓的不對稱B-H鍵插入反應,并能以高收率和對映選擇性得到一系列手性γ,γ-二取代烯丙基偕-甲硅烷基硼烷衍生物。該方法也適用于各種3,3-二取代甲硅烷基環丙烯,得到的產物均為E-構型產物。這種新型手性γ,γ-二取代烯丙基偕-甲硅烷基硼烷衍生物是一種通用的烯丙基雙金屬試劑,穩定性高,具有巨大的合成潛力,尤其適用于構建具有相鄰手性中心的復雜分子。相關研究成果發表于Angew. Chem. Int. Ed.(DOI: 10.1002/anie.202203343)。
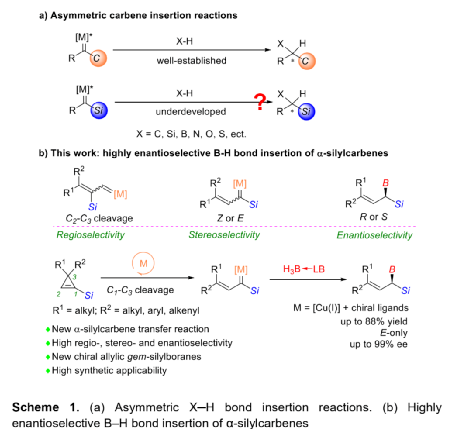
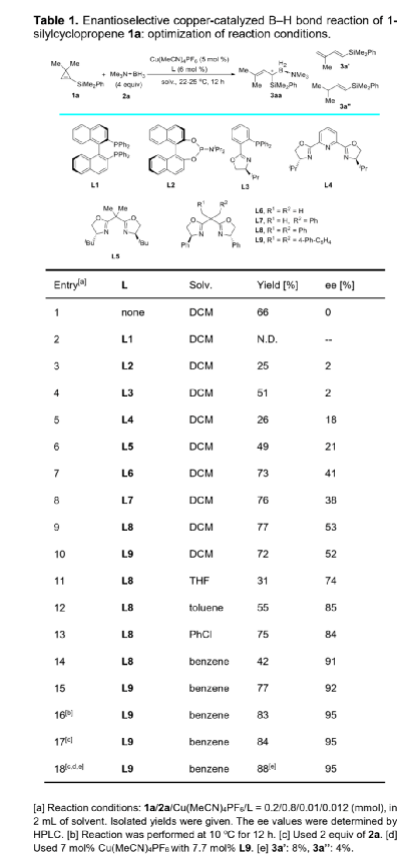
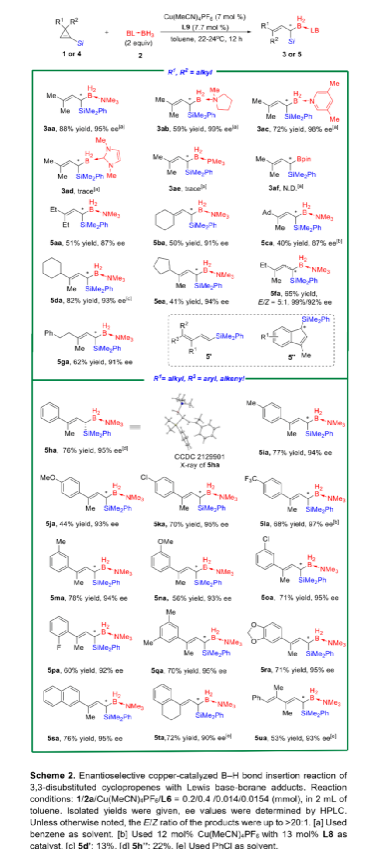
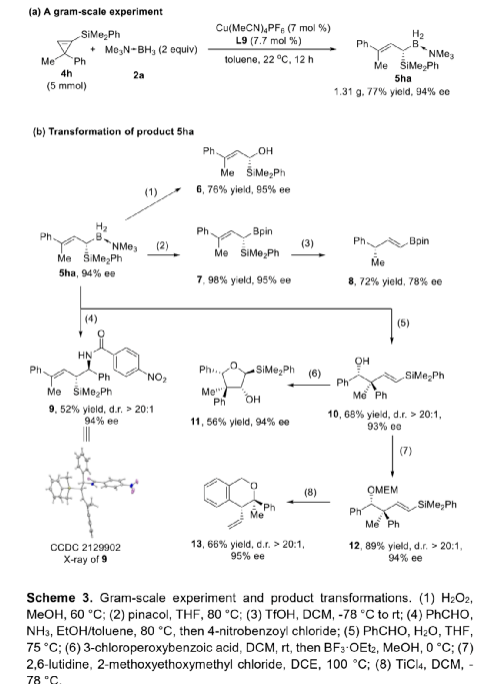
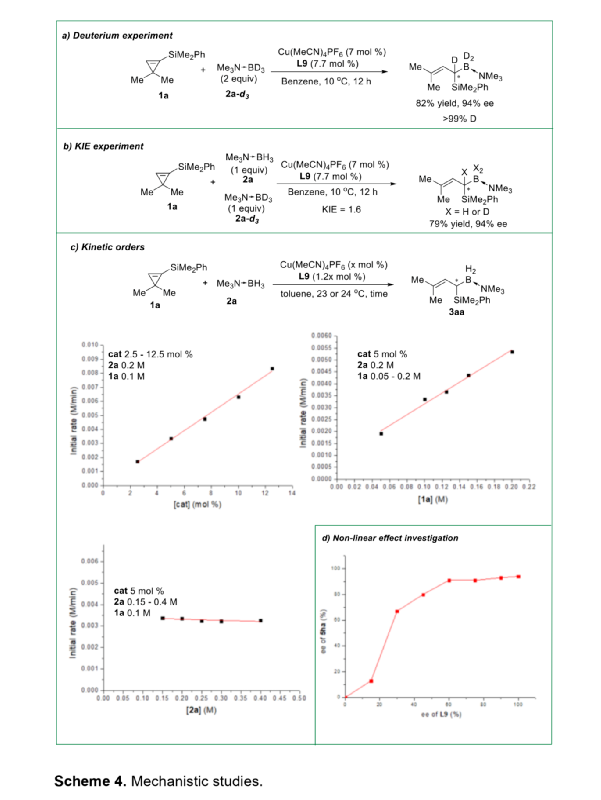
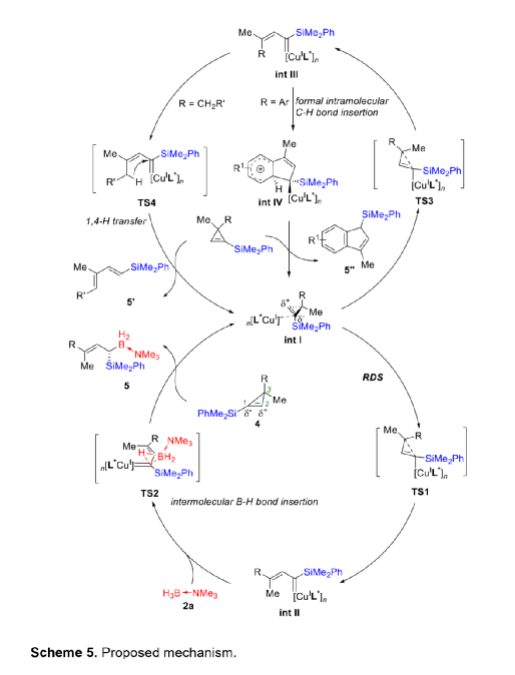
α-甲硅烷基卡賓是一類穩定性相對較高的功能性卡賓,它的不對稱性轉移反應可用于制備多樣的手性有機硅烷類化合物。與研究較多的α-碳卡賓相比,關于α-甲硅烷基卡賓的不對稱性轉移反應的報道寥寥無幾,可能是因為α-甲硅烷基卡賓的前體來源比較受限且缺乏有效的催化策略(Scheme 1a)。二銠或銅催化以α-甲硅烷基重氮化合物為前體的α-硅基卡賓發生不對稱環丙烷化反應,可以有效的合成手性硅烷基環丙烷類化合物,但未有關于α-甲硅烷基卡賓發生高對映選擇性插入反應的相關報道。最近,南開大學化學學院朱守非課題組開發了銅(I)/手性雙噁唑啉絡合物催化以1-甲硅烷基環丙烯為前體的α-甲硅烷基α-乙烯基卡賓的不對稱B-H鍵插入反應,并能以高對映選擇性得到一系列手性γ,γ-二取代烯丙基偕-甲硅烷基硼烷衍生物(Scheme 1b)。為了實現該策略,作者解決了以下難題:(1)在開環過程中,1-甲硅烷基環丙烯發生區域選擇性C1-C3鍵的斷裂,生成α-甲硅烷基-α-乙烯基金屬卡賓中間體;(2)當R1和R2取代基不同時,該方法成功控制了C=C鍵的立體選擇性;(3)該方法實現了高對映選擇性B-H鍵插入。值的一提的是,目前僅有兩例關于高對映選擇性合成手性烯丙基偕-甲硅烷基硼烷的報道,且這些報道合成的均為手性γ-單取代偕-甲硅烷基硼烷衍生物,而手性γ,γ-二取代烯丙基偕-甲硅烷基硼衍生物的合成方法還有待開發。下載化學加APP,閱讀更有效率。(圖片來源:Angew. Chem. Int. Ed.)作者以1-甲硅烷基環丙烯1a和硼烷絡合物2a為模板底物,通過對催化劑、溶劑以及溫度等條件進行篩選,確定最優反應條件(Table 1):以7 mol% Cu(MeCN)4PF6和7.7 mol% L9為催化劑,以甲苯為溶劑,在22-25 oC條件下反應12 h,反應能以88%的收率和95%的對映選擇性得到手性偕-甲硅烷基硼烷衍生物3aa。(圖片來源:Angew. Chem. Int. Ed.)在最優反應條件下,作者考察了反應的底物范圍(Scheme 2)。硼烷絡合物中Lewis堿的性質對反應結果影響較大。當硼烷絡合物中Lewis堿為胺或吡啶等N-配合物時,反應能以中等至良好的收率和優異的對映選擇性得到產物3aa-3ac。但對于C-配合物、P-配合物,反應均不能正常進行(3ad-3ae)。若將硼烷絡合物換成HBpin,反應也不能發生(3af)。隨后,作者對3,3-二取代1-甲硅烷基環丙烯的底物范圍進行了考察。對稱的3,3-二烷基-1-甲硅烷基環丙烯可以中等至良好的產率和良好至優秀的對映選擇性得到產物5aa-5ba。不對稱的3,3-二烷基-1-甲硅烷基環丙烯、3-芳基3-烷基-1-甲硅烷基環丙烯、稠環丙烯以及3-烯基取代的環丙烯也能較好的適應反應條件,并能以中等至良好的產率和良好至優秀的對映選擇性得到E-構型產物5ca-5ua,反應中還檢測到(Z)-α-甲硅烷基α-乙烯基卡賓中間體轉化的副產物5’和5’’。其中,5ha的絕對構型通過X-單晶衍射分析確定為S-構型。(圖片來源:Angew. Chem. Int. Ed.)為了證明反應的應用潛力,作者進行了規模化反應和衍生反應(Scheme 3)。該反應可以擴大至克級規模,能以77%的收率和94%的ee值得到5ha。加熱條件下,5ha可被H2O2氧化為α-甲硅烷醇6。同時,5ha中的硼烷部分易于轉化為頻哪醇硼酸酯,得到產物7。在TfOH存在下,7發生不對稱烯丙基去甲硅烷基化反應得到手性烯基硼酸酯8。此外,5ha還可與亞胺反應生成反式2-甲硅烷基高烯丙基胺化產物9,其中,9的絕對構型通過X-單晶衍射分析確定。若5ha與苯甲醛的反應則可生成高烯丙醇10。在BF3·OEt2存在下,10的環氧化產物可進一步發生分子內環化反應生成四氫呋喃衍生物11。10與2-甲氧基乙氧基甲基氯反應生成的縮醛12可進一步發生區域選擇性重排反應手性異色滿衍生物13。(圖片來源:Angew. Chem. Int. Ed.)氘代實驗結果表明硼和氘原子均加成在相同的碳上,這表明反應中生成了卡賓中間體(Scheme 4a)。動力學同位素效應的結果表明氫轉移步驟速度很快(Scheme 4b)。作者通過原位紅外光譜測量甲苯中不同濃度的各組分的初始反應速率,從而探究反應順序(Scheme 4c)。速率結果顯示催化劑的濃度和1-甲硅烷基環丙烯1a的濃度成正線性相關,這表明Cu(I)介導的環丙烯開環形成金屬卡賓的過程可能是速率決定步驟。而5ha的ee值與配體L9的ee值成正非線性相關(Scheme 4d)。該結果表明催化劑中Cu(I)與配體L9不是以1:1的形式絡合。(圖片來源:Angew. Chem. Int. Ed.)基于上述結果,作者提出可能的機理(Scheme 5):首先,甲硅烷基未成鍵的3d軌道和π鍵相互誘導,環丙烯以極化形式存在即C1的負電荷多于比C2的負電荷;然后,親核的銅催化劑進攻極化的環丙烯的C1位,導致C1-C3鍵發生區域選擇性斷裂,從而生成E-型或Z-型α-甲硅烷基-α-乙烯基卡賓中間體;隨后,E-型卡賓(int II)經歷三元環過渡態TS2發生對映選擇性B-H鍵插入反應,生成手性烯丙基偕-甲硅烷基硼烷5。而Z-型卡賓(int III)則以不同的途徑發生反應:當R為烷基時,int III發生1,4-氫轉移過程生成1-甲硅烷基二烯5';當R是芳基時,int III發生分子內芳環上親電進攻后進行1,2-質子轉移得到分子內C-H插入產物5''。(圖片來源:Angew. Chem. Int. Ed.)小結:南開大學化學學院朱守非課題組開發了銅(I)/手性雙噁唑啉絡合物催化以1-甲硅烷基環丙烯為前體的α-甲硅烷基α-乙烯基卡賓的不對稱B-H鍵插入反應,并能以高收率和對映選擇性得到一系列手性γ,γ-二取代烯丙基偕-甲硅烷基硼烷衍生物。該方法也適用于各種3,3-二取代甲硅烷基環丙烯,得到的產物均為E-構型產物。該反應可以擴大至克級規模,手性產物可進行多樣的衍生化反應。同時,通過機理實驗,作者提出了可能的反應機理。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn