

馮小明院士的主要研究領域是:新型手性催化劑的設計合成、不對稱催化反應、手性藥物和生理活性化合物的高效高選擇性合成。馮小明院士團隊以廉價易得的氨基酸為原料,設計合成了多種新型手性配體和催化劑,其中手性雙氮氧化合物被稱為“馮氏配體”,已實現商業化,面向全世界銷售。利用“馮氏配體”的第一例不對稱催化α-取代重氮酯與醛的反應,被業內冠名為Roskamp-Feng反應,為一些重要生理活性手性化合物的合成提供了有效方法。
吳云東院士的主要研究領域是:理論與計算有機化學的研究 ,他們團隊主要通過理論方法去探究過渡金屬不對稱催化機理及其立體化學。
2021年,馮小明院士團隊和吳云東院士團隊強強聯手,基于手性雙氮氧化合物即 “馮氏配體”的催化體系,實現了一系列重要的不對稱反應,并進行了機理研究,連續在JACS上發表了四篇高水平學術論文。2022年,兩位院士再次合作,在Angew上報道了“馮氏配體”催化的硫酮的不對稱催化(2+1)環加成合成四取代硫雜環丙烷。下面,我們按照時間順序對這五篇精彩文章予以解讀賞析。下載化學加APP,閱讀更有效率。
JACS:酮與α-烷基α-重氮酯的催化不對稱同系化
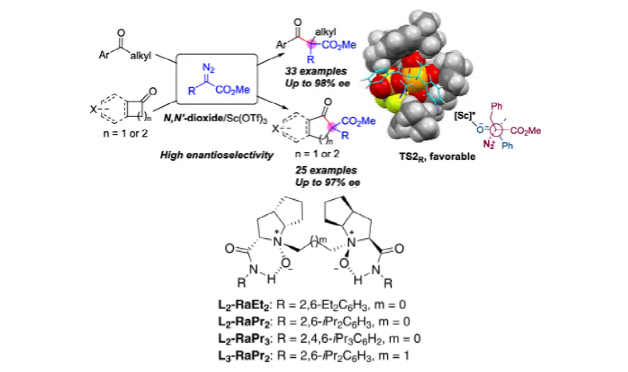
圖1. 利用L2-RaPr3/鈧催化體系實現酮與重氮化合物的同系化(圖片來源:J. Am. Chem. Soc.)
酮與重氮化合物的同系化是合成單碳擴鏈無環酮或擴環環酮的有效策略。然而,由于較低的反應性和復雜的選擇性,無環酮與α-重氮酯的不對稱同系化仍然是一個挑戰。作者報道了苯乙酮和相關衍生物與α-烷基α-重氮酯的對映選擇性催化同系化,該反應使用手性鈧(III)-N,N'-雙氧化物作為路易斯酸催化劑。為通過酮的高選擇性烷基遷移合成具有全碳季碳中心的光學活性β-酮酯提供了高化學、區域和對映選擇性途徑,ee值高達98%。此外,環酮的擴環是在稍微改變的條件下完成的,得到了一系列對映體富集的環狀β-酮酯,ee值高達97%。作者還進行了密度泛函理論計算以闡明反應途徑和可能的模型,這些模型可以解釋觀察到的區域選擇性和對映選擇性(圖1)。
JACS:高自旋鈷(II)配合物催化的脂肪族仲胺的對映選擇性形式插烯N-H插入
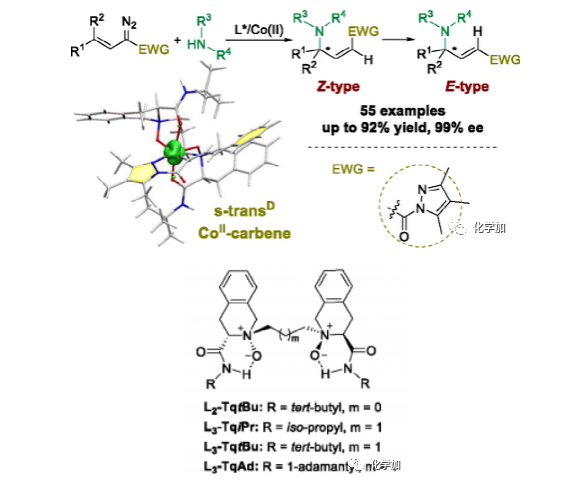
圖2. 利用L3-TqtBu/鈷(II)配合物催化劑實現高選擇性插烯N-H插入(圖片來源:J. Am. Chem. Soc.)
乙烯基卡賓插入胺的氮-氫(N-H)鍵能直接獲得α,β-不飽和γ-氨基酸衍生物,在控制區域選擇性和對映選擇性方面極具挑戰。作者報道了使用高自旋手性 N,N'-雙氧化物/鈷(II)配合物催化劑,實現了具有乙烯基取代的α-重氮吡唑酰胺的脂肪族或芳香族仲胺的高度γ-選擇性和對映選擇性的N-H鍵插入,產率高達92%,ee值高達99%。該方法提供了多種有價值的光學活性Z-型和E-型乙烯基γ-氨基酰胺。計算化學實驗揭示了從四重鈷(II)配合物到雙重鈷(II)-卡賓物種的自旋態變化,用于方便的Z-選擇性和對映選擇性親核加成(圖2)。
JACS:α,β-不飽和羰基化合物的鐵催化對映選擇性自由基碳疊氮化和二疊氮化
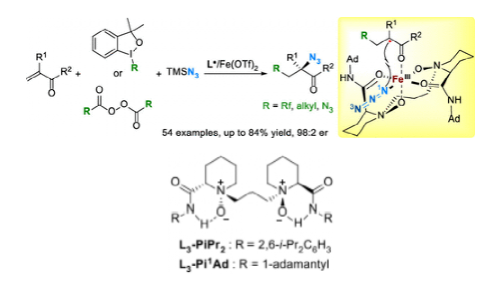
圖3. 利用L3-Pi1Ad/鐵催化劑實現高選擇性碳疊氮化和二疊氮化(圖片來源:J. Am. Chem. Soc.)
烯烴的疊氮化是合成有機疊氮化物的有效方法,有機疊氮化物是有機合成中的重要結構單元。由于自由基固有的不穩定性和獨特的結構,對映選擇性自由基疊氮化作為一種安裝C-N3鍵的有用策略仍然具有挑戰性。作者報道了由手性N,N'-雙氧化物/Fe(OTf)2配合物催化的α,β-不飽和酮和酰胺的高效對映選擇性自由基碳疊氮化和二疊氮化。一系列取代的烯烴被轉化為相應的α-疊氮羰基衍生物,具有良好的對映選擇性,有利于制備手性α-氨基酮、連氨基醇和連二胺, 產率高達84%,er值高達98:2。對照實驗和機理研究證明了反應過程中的自由基途徑。DFT計算表明疊氮基通過分子內五元過渡態與Fe-N3物種的內部氮轉移到自由基中間體(圖3)。
JACS:通過甲硅烷基乙烯酮亞胺與1-丙烯酰基吡唑的Michael反應,對映選擇性合成含季碳中心的腈
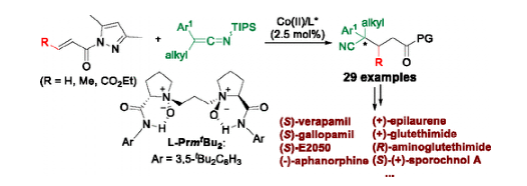
圖4. 利用L-PrmtBu2/鈷催化劑合成含季碳中心的腈(圖片來源:J. Am. Chem. Soc.)
季碳中心的對映選擇性構建是不對稱催化研究中的一個顯著挑戰。當手性催化劑不能通過鍵相互作用區分底物的面選擇性時,這是非常困難的。作者使用手性 N,N'-雙氧化物-Co(II)配合物實現了甲硅烷基乙烯酮亞胺與1-丙烯酰基吡唑的對映選擇性Michael反應(圖4)。該方案對于構建含腈、芳基和二烷基的碳中心非常有效,并已成功應用于藥物和天然產物的多樣性合成(圖5)。未結合的甲硅烷基乙烯酮亞胺和 1-丙烯酰基吡唑鍵合的催化劑之間的空間分散相互作用在促進該過程的反應性和對映選擇性方面起著關鍵作用。
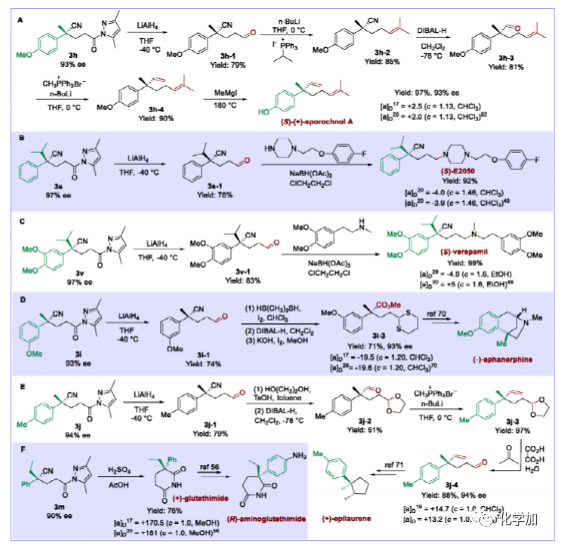
圖5. 反應產物用于手性藥物及天然產物的合成(圖片來源:J. Am. Chem. Soc.)
Angew:硫酮的不對稱催化(2+1)環加成合成四取代硫雜環丙烷
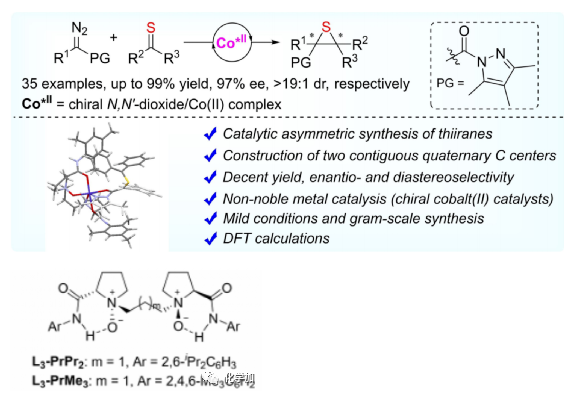
圖6. 利用L3-PrMe3/鈷催化體系合成四取代硫雜環丙烷
(圖片來源:Angew. Chem. Int. Ed.)
近期,作者報道了首例硫酮與α-重氮吡唑酰胺的對映選擇性(2+1)環加成直接合成四取代硫雜丙環。在手性N,N'-雙氧化物/鈷(II)配合物(2-5 mol%)存在下,具有出色的效率(在15分鐘內產率高達99%)和高立體選擇性(高達>19: 1 dr和97 % ee)。還進行了通過脫硫對硫雜丙環的加工以提供四取代烯烴(圖6)。密度泛函理論計算表明,該反應從雙重態鈷(II)類卡賓開始,隨后是四重態鈷(II)結合的硫代羰基葉立德途徑。這項工作為選擇性構建難以獲得的四取代硫雜丙環和烯烴提供了途徑。
作者進行對照實驗以深入了解環加成。α-重氮吡唑酰胺A1與二苯甲酮E1和1,1-二苯基乙烯E2的反應分別在有或沒有Co(OTf)2/L3-PrMe3復合物的情況下進行。結果表明,在兩種情況下都沒有檢測到所需的產物F1和F2,同時回收了E1和E2,這表明了硫酮的獨特性質。此外,其他重氮底物,如α-重氮酯A1'和α-重氮吡咯酰胺A2',被用于與催化體系中的硫酮B1反應。F3和F4在反應時間、產率和對映選擇性(<3% ee)方面的較差結果證明了吡唑酰胺單元在該轉化中的必要性。
還通過硫雜環丙烷C1或C33的脫硫,即Barton-Kellogg烯化,在不同條件下以良好的產率得到了四取代烯烴D1-D4。這些結果表明,硫雜丙環的三元環的高張力更有可能通過脫硫釋放,而不是取代反應、開環或擴環。值得注意的是,當使用具有高非對映選擇性的硫雜環丙烷C33時,以高E/Z選擇性獲得四取代烯烴D3和D4(圖7)。
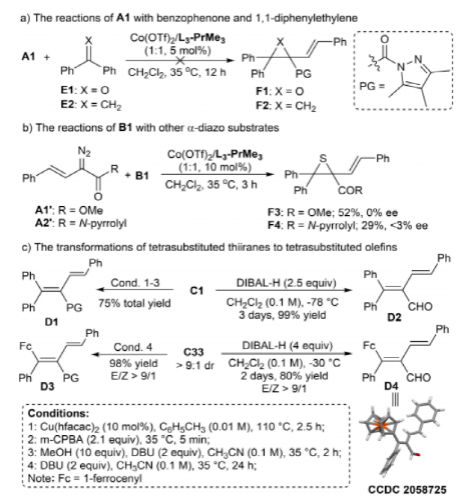
圖7. 控制實驗及硫雜三元環的轉化(圖片來源:Angew. Chem. Int. Ed.)
為了獲得更多關于環加成對映選擇性起源的信息,作者進行了DFT計算。圖8顯示了A1與B1通過CoΙΙ/L3-PrMe3反應的自由能面。首先,重氮結合的CoII中間體Int1被認為是后續研究的活性物種。研究了N2釋放可能通過雙重態或四重態過渡態發生的兩種途徑。結果表明,四重態途徑比雙重態途徑更有利,產生自旋交叉產物Co(II)卡賓物種Int2D。然后,中間體Int2D被硫酮的硫原子親核進攻,得到Co(II)結合的硫代羰基葉立德 Int3Q,它比游離的硫代羰基葉立德更穩定。由于配體L3-PrMe3的氨基酸骨架的空間位阻,硫代羰基葉立德的閉環步驟在不太擁擠的過渡態(TS2-S,ΔΔG = 3.3 kcalmol-1)下進行,從而得到硫雜環丙烷(S)-C1,具有高對映選擇性。
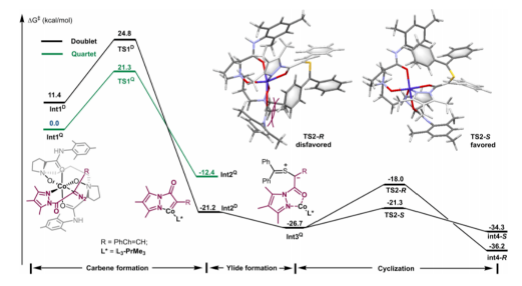
圖8. DFT計算研究(圖片來源:Angew. Chem. Int. Ed.)
總結:馮小明院士團隊通過使用高度可調的手性N,N'-雙氧化物/過渡金屬催化劑,成功地開發了多種不對稱反應。這些反應都具有廣泛的底物范圍、高產率、良好的立體選擇性。吳云東院士團隊通過DFT計算對于理解反應機理和對映選擇性的起源提供了重要支持。值得一提的是,這種手性雙氮氧的“馮氏配體”不僅商業可得,而且能夠廣泛用于多種不對稱有機反應,對于不對稱有機合成和藥物合成都具有重要意義。
友情提示:在化學加網或化學加APP上可以搜索到“馮氏配體”相關信息,以其中的“馮氏配體”PBnPPi為例,輸入CAS:1085279-20-4即可查到相關信息。
參考文獻:
[1] J. Am. Chem. Soc. 2021, 143, 2394-2402.
[2] J. Am. Chem. Soc. 2021, 143, 9648-9656.
[3] J. Am. Chem. Soc. 2021, 143, 11856-11863.
[4] J. Am. Chem. Soc. 2021, 143, 19091-19098.
[5] Angew. Chem. Int. Ed. 2022, DOI: 10.1002/anie.202201151.
[6] 馮小明院士課題組主頁:http://www.scu.edu.cn/chem_asl/
[7] 吳云東院士課題組主頁:https://web.pkusz.edu.cn/wu/
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn