



北京時(shí)間5月6日凌晨,同濟(jì)大學(xué)生命科學(xué)與技術(shù)學(xué)院高紹榮/高亞威教授團(tuán)隊(duì)與美國(guó)芝加哥大學(xué)何川教授合作在《科學(xué)》(Science)上在線(xiàn)發(fā)表了題為《FTO在mESCs和小鼠發(fā)育中介導(dǎo)LINE1 m6A去甲基化和染色質(zhì)調(diào)節(jié)》(FTO mediates LINE1 m6A demethylation and chromatin regulation in mESCs and mouse development)的文章,研究發(fā)現(xiàn)在小鼠胚胎干細(xì)胞(mESCs)小鼠和人類(lèi)組織以及小鼠卵母細(xì)胞及早期發(fā)育中,F(xiàn)TO可以調(diào)控染色質(zhì)相關(guān)RNA,影響染色質(zhì)開(kāi)放與組蛋白修飾,從而影響mESCs的增殖分化以及早期胚胎的正常發(fā)育。據(jù)介紹,該研究對(duì)于解析哺乳動(dòng)物及其發(fā)育中RNA m6A修飾動(dòng)態(tài)調(diào)控的生物學(xué)功能,具有重要意義。

N6-甲基腺嘌呤(m6A)是真核生物mRNA內(nèi)部最常見(jiàn)和研究最為廣泛的修飾,受“書(shū)寫(xiě)”蛋白,“擦除”蛋白調(diào)控并經(jīng)“閱讀”蛋白實(shí)現(xiàn)功能。m6A對(duì)于mRNA的命運(yùn)調(diào)控影響重大,參與剪接、轉(zhuǎn)運(yùn)、降解、翻譯、與相分離等過(guò)程的調(diào)控。它影響了個(gè)體發(fā)育和分化等生命過(guò)程,并被發(fā)現(xiàn)在多種疾病特別是癌癥和免疫類(lèi)疾病中發(fā)揮重要作用。但m6A擦除蛋白介導(dǎo)的動(dòng)態(tài)去甲基化在這一調(diào)控中的作用,以及其在哺乳動(dòng)物發(fā)育過(guò)程中的功能仍缺少深入研究。
FTO是首個(gè)被鑒定的RNA去甲基化酶。FTO與哺乳動(dòng)物發(fā)育和多種人類(lèi)疾病相關(guān),并參與癌癥發(fā)生發(fā)展的調(diào)控。美國(guó)芝加哥大學(xué)何川教授和高亞威/高紹榮教授團(tuán)隊(duì)在研究中發(fā)現(xiàn)FTO敲除的雜合子小鼠產(chǎn)生純合敲除后代比例偏低,且純合敲除的雌性小鼠無(wú)法產(chǎn)生健康存活的后代,提示小鼠的FTO蛋白可能對(duì)于生殖發(fā)育等過(guò)程非常重要。團(tuán)隊(duì)利用FTO敲除的雜合小鼠自交產(chǎn)生的胚胎,建立了FTO敲除的胚胎干細(xì)胞細(xì)胞系(Fto-/-mESC)。研究人員分析發(fā)現(xiàn)FTO敲除會(huì)引起mESC中染色質(zhì)相關(guān)RNA(caRNA)的m6A修飾水平上升,并且能夠引發(fā)基因組水平的轉(zhuǎn)錄活性下降與染色質(zhì)開(kāi)放程度降低,這些變化會(huì)在引發(fā)細(xì)胞增殖缺陷的同時(shí)損害細(xì)胞的體內(nèi)和體外分化潛能。
合作團(tuán)隊(duì)通過(guò)多種組學(xué)技術(shù)的聯(lián)合分析發(fā)現(xiàn),F(xiàn)TO敲除后會(huì)影響基因組中逆轉(zhuǎn)座子LINE1的RNA上出現(xiàn)m6A修飾累積,并引發(fā)RNA的降解加速以及轉(zhuǎn)錄活性的下降,從而降低了LINE1的RNA豐度。不僅如此,研究者還發(fā)現(xiàn)LINE1 RNA下降,也影響了LINE1 對(duì)于下游靶標(biāo)基因(包括2C基因和逆轉(zhuǎn)座子)的轉(zhuǎn)錄沉默。同時(shí)LINE1附近編碼基因會(huì)隨著LINE1豐度的降低,而呈現(xiàn)明顯的轉(zhuǎn)錄本豐度和轉(zhuǎn)錄活性的下降,其中包括了大量與干細(xì)胞分化和個(gè)體發(fā)育相關(guān)的重要基因。

圖1. FTO調(diào)控LINE1 RNA表達(dá)和附近染色質(zhì)狀態(tài)以及對(duì)LINE1-containing基因表達(dá)的順式調(diào)控
同濟(jì)的研究團(tuán)隊(duì)利用自身在胚胎發(fā)育研究中的修飾,證明FTO蛋白缺失會(huì)影響卵母細(xì)胞的分化成熟,并且這種缺陷型的卵細(xì)胞在FTO蛋白完全缺失的情況下,將存在嚴(yán)重的著床與發(fā)育問(wèn)題。團(tuán)隊(duì)成功證明FTO在卵母細(xì)胞發(fā)育和早期胚胎中參與LINE1 RNA的調(diào)控,并且同樣會(huì)參與細(xì)胞核內(nèi)染色質(zhì)開(kāi)放,LINE1下游靶標(biāo)基因(包括2C基因和逆轉(zhuǎn)座子),以及LINE1附近編碼基因的轉(zhuǎn)錄活性調(diào)控。團(tuán)隊(duì)使用LINE1 RNA位點(diǎn)特異性m6A擦除系統(tǒng),證明了LINE1 RNA豐度,核內(nèi)染色質(zhì)開(kāi)發(fā)以及編碼基因的異常確實(shí)由LINE1上的m6A修飾累積引發(fā)。
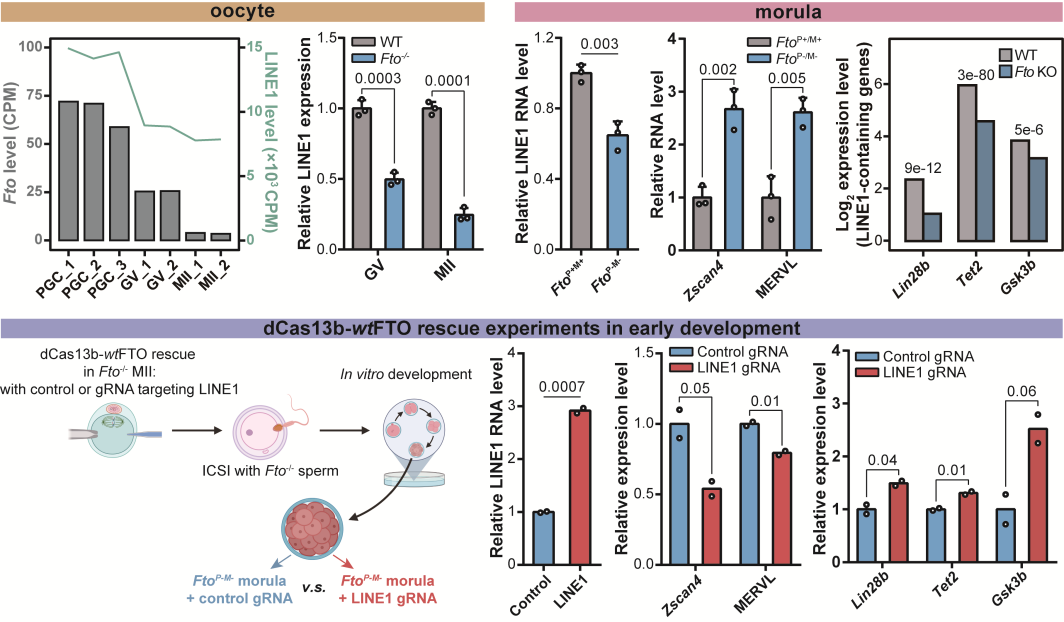
圖2. FTO參與卵發(fā)育與早期胚胎中LINE1 RNA及下游基因的調(diào)控
高紹榮教授介紹,這項(xiàng)工作鑒定了LINE1 RNA m6A是FTO在mESCs里和小鼠發(fā)育過(guò)程中主要的功能相關(guān)底物,不僅在細(xì)胞系中闡述了FTO通過(guò)調(diào)控LINE1 RNA的表觀修飾實(shí)現(xiàn)核染色質(zhì)表觀修飾和LINE1下游及富集基因表達(dá)的新機(jī)制,還在體內(nèi)發(fā)育中證明了這一機(jī)制。這項(xiàng)工作對(duì)于我們進(jìn)一步解析生命過(guò)程的分子調(diào)控機(jī)制,提供了新的研究視角。
此外,賈桂芳/何川/宋寶安教授團(tuán)隊(duì)利用過(guò)表達(dá)FTO使水稻和馬鈴薯增產(chǎn)50%,其分子機(jī)制可能也與植物里repeat RNA的m6A去甲基化和染色質(zhì)調(diào)控相關(guān),提示了repeat RNA的m6A去甲基化可能對(duì)不同物種體系內(nèi)的表觀系統(tǒng)都具有重要調(diào)控功能。
芝加哥大學(xué)魏江博博士、余賢斌博士,同濟(jì)大學(xué)博士生楊磊、劉雪蓮為論文的共同第一作者。芝加哥大學(xué)何川教授,同濟(jì)大學(xué)高紹榮教授、高亞威教授為本文的共同通訊作者。浙江大學(xué)李學(xué)坤教授、南京醫(yī)科大學(xué)黃伯賢副研究員和北京大學(xué)劉君研究員也參與了這一工作。該工作得到實(shí)驗(yàn)室其他成員和合作團(tuán)隊(duì)的大力支持。高紹榮、高亞威團(tuán)隊(duì)研究得到了科技部、國(guó)家自然科學(xué)基金委以及上海市科委等項(xiàng)目的支持。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話(huà):18676881059,郵箱:gongjian@huaxuejia.cn