

導語
腫瘤是危害人民生命和健康的重大惡性疾病之一,化學藥物目前仍是治療腫瘤的最為主要的手段之一。因此,開展更為深入系統的抗腫瘤藥物創制具有重要的現實和戰略意義。在抗腫瘤藥物開發過程中,中藥資源是蘊含具抗腫瘤活性化合物的天然寶庫,亦是發掘新一代抗腫瘤先導結構的重要源泉。天然源生物堿作為自然界中廣泛分布的一類重要含氮天然產物,因其結構的豐富性和活性多樣性,以及與受體結合的特異性功能,為發現新藥先導結構提供了有價值的線索,成為人們尋找活性化合物的最佳向導,已引導和啟發了很多重要的新藥發明。尤其是喜樹堿作為一個“經典”老兵,仍在在抗腫瘤藥物開發方面續寫著“新傳”,以其為先導經優化獲得了數十個上市或進入臨床試驗階段的候選藥物。近年來,蘭州大學劉映前團隊以喜樹堿為為修飾和結構優化目標,綜合運用多樣性導向合成、生物電子等排、骨架躍遷、活性官能團導向設計以及活性合成子后修飾策略等分子優化操作,融合多層次化學結構特征系統開展了基于喜樹堿類Top I抑制劑的新化學實體的設計合成與結構優化研究,已取得了一系列重要研究成果,獲得了以YQL-9a、WCN-21、WCN-171和WCN-215等為代表的具有開發前景的高活性候選先導,同時,該團隊也開展了非喜樹堿類Top I抑制劑的先導發現與結構優化研究,獲得了以YCJ-02、X-25等為代表的高活性先導,其系列相關成果已在藥物化學高水平期刊Med. Res. Rev.、J. Med. Chem、Europ. J. Med. Chem、Bioorg. Chem.、Bioorg. Med. Chem.、Biochem. Pharmacol.等雜志上發表。
劉映前課題組簡介:
劉映前教授團隊以“天然藥物化學生物學/藥物化學”為主要研究方向,長期致力于中藥與天然源生物活性功能分子的先導發現、多樣性導向合成、藥效評價及其應用開發研究,尤其是課題組聚焦“天然源生物堿”的功效挖掘和新藥創制方面形成了一定的特色,獲得了多個具應用前景的候選先導。其系列成果已在Med. Res. Rev.、J. Med. Chem、Europ. J. Med. Chem等雜志發表SCI論文近百篇,受邀以“中藥及藥用植物資源--生物堿 “專題在藥物化學Top雜志Med. Res. Rev.撰寫了專題性系列報道,作為副主編參編論著3部, 為《The Alkaloids: Chemistry and Biology》專刊撰寫題為《Biology of quinoline and quinazoline alkaloids》章節內容。其相關成果申請國家發明專利100余件,PCT專利1件,申請軟件著作權2項,成果轉化5項。
劉映前教授簡介:

劉映前 :博士/博士后,教授/博導,甘肅省飛天學者,甘肅省隴原青年創新創業團隊負責人,甘肅省中藏藥功效物質開發與利用行業技術中心負責人,天然藥物化學生物學研究所所長。曾任藥學院院長,甘肅省藥學會副理事長。現兼任中國民族醫藥協會民族醫藥教育專業委員會副會長,世界中聯中醫與農業產業分會第一屆專家委員會委員,中國生物醫藥整合聯盟理事,中國民族醫藥協會芳香醫藥分會副主任委員,甘肅省院內制劑產業技術創新戰略聯盟副理事長,甘肅省化學會理事、甘肅省化學會藥物化學主任委員和甘肅省藥學會天然藥物與醫藥產業經濟主任委員等職務。近年來,課題組發表高水平SCI論文發表近百篇,申請國家發明專利100余件,PCT專利1件,申請軟件著作權2項,成果轉化5項。承擔國家重點研發計劃、國家自然科學基金、甘肅省重點研發計劃、甘肅省科技創新專項等科技項目30余項,服務企業合作橫向項目以及與企業聯合的產學研課題60余項。先后獲甘肅藥學會藥學發展一、二等獎、中華中醫藥學會科學技術獎(政策研究獎)、南京市科技進步三等獎等獎例。
有關喜樹堿類生物堿及非喜樹堿類Top I抑制劑的代表性科研成果總覽與介紹:
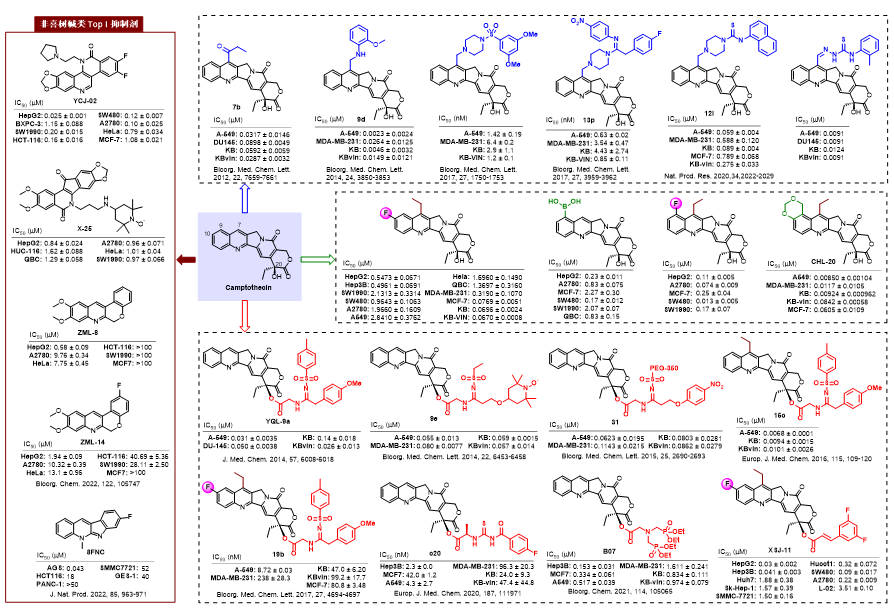
(1)代表性成果介紹-1:20(S)-喜樹堿的磺酰脒衍生物的抗腫瘤活性評價及其機制研究:
本研究通過銅催化的三組分反應設計合成了一系列新型20(S)-喜樹堿磺酰脒衍生物,與伊立替康相比,它們對A-549、DU-145、KB和多藥耐藥(MDR)KBvin腫瘤細胞系顯示出相近或更強的細胞毒性。從機理上講,YQL-9a通過選擇性抑制拓撲異構酶(Topo)I和激活ATM/Chk相關的DNA損傷反應途徑,顯著誘導DNA損傷。在異種移植模型中,YQL-9a在5 mg/kg和10 mg/kg時表現出顯著的活性,沒有明顯的不良反應。值得注意的是,與喜樹堿(LD50 56.2 mg/kg,i.p.)和伊立替康(LD50 177.5 mg/kg,i.p.)相比,在300 mg/kg(i.p.)的高濃度給藥下YQL-9a仍沒有明顯毒性。此外,YQL-9a以類似于喜樹堿的方式抑制拓撲異構酶I活性,證實YQL-9a是一類新的拓撲異構酶I抑制劑,獲得了以YQL-9a為代表的全新候選先導,為其進一步開發奠定理論基礎。
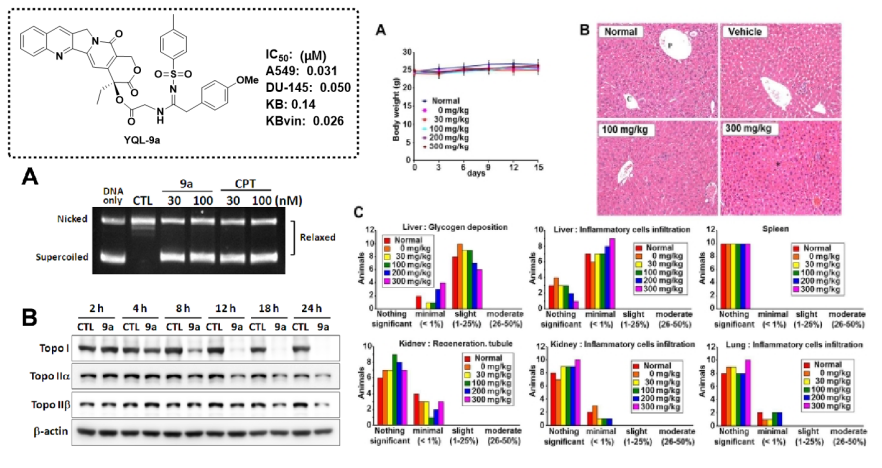
(2)代表性成果介紹-2:20(S)-喜樹堿的酰基硫脲衍生物的抗腫瘤活性評價及其機制研究:
本研究設計合成了新型20(S)-喜樹堿酰基硫脲衍生物,并評價其對六種腫瘤細胞系(Hep3B、MCF7、A549、MDA-MB-231、KB和KB vin)的體外細胞毒活性。其中,化合物c20具有顯著的體外細胞毒活性,比拓撲替康更有效。從機制上講,c20不僅能誘導A549細胞的細胞周期阻滯和細胞凋亡,而且以類似于拓撲替康的方式抑制拓撲異構酶I的活性。在異種移植和原發性肝癌小鼠模型中,c20顯示出顯著的體內抗癌活性,并且比拓撲替康更有效。此外,急性毒性試驗表明,c20對FVB/N小鼠的肝臟、腎臟和造血系統沒有明顯毒性。獲得了以c20為代表的全新候選先導,為其進一步開發奠定理論基礎。
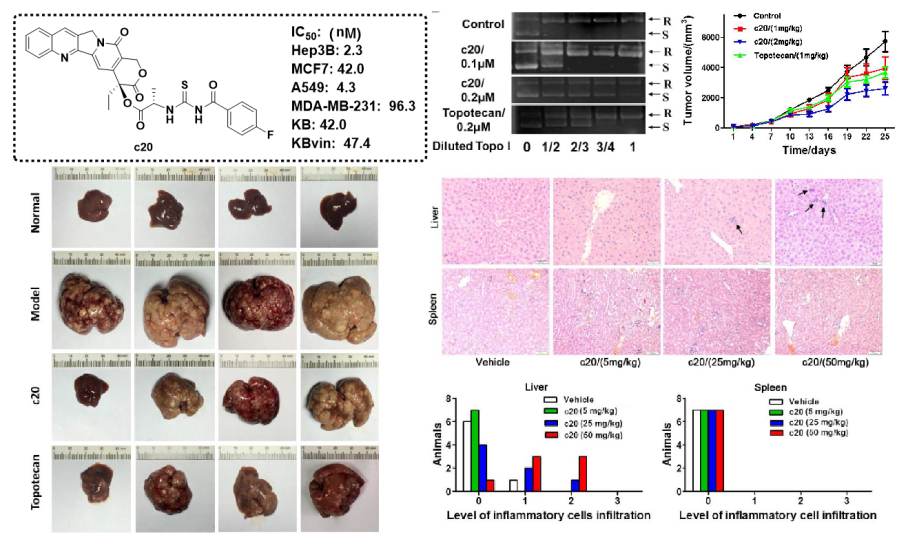
(3)代表性成果-3:20(S)-喜樹堿的氨基膦酸酯衍生物的抗腫瘤活性評價及其機制研究
本研究通過FeCl3催化一鍋法合成了新型喜樹堿20(S)-氨基膦酸酯衍生物。與伊立替康相比,所有這些化合物對Hep3B、MCF-7、A-549、MDA-MB-231、KB和多藥耐藥(MDR)KB-vin細胞系顯示出相近或更強的細胞毒性活性。其中,化合物B07顯示出顯著的細胞毒性,活性比伊立替康提高10倍。機制上,B07不僅誘導Hep3B和MCF-7細胞凋亡和細胞周期阻滯,而且以類似于伊立替康的方式抑制拓撲異構酶I活性。在異種移植和原發性肝癌小鼠模型中,B07顯示出顯著的抗腫瘤活性,并且比伊立替康更有效。此外,急性毒性試驗表明B07對FVB/N小鼠的肝臟、腎臟和造血系統沒有明顯毒性。因此,這些研究表明化合物B07可能是一種潛在的拓撲異構酶I藥候選藥物,可用于進一步的臨床試驗。
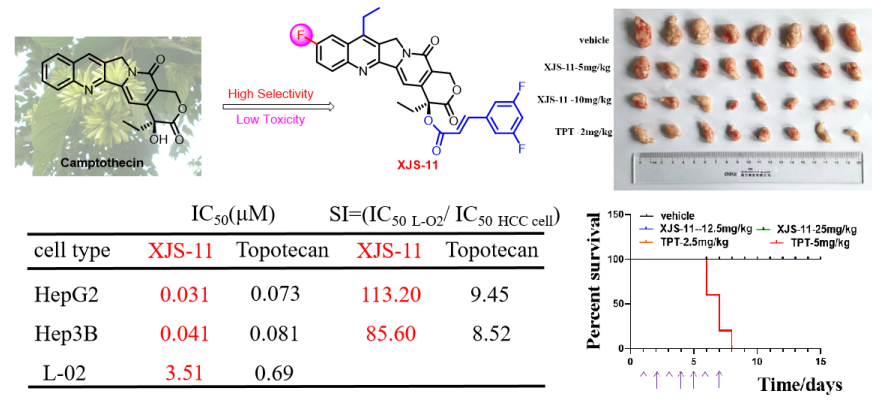
(4)代表性成果-4:7-乙基-10-氟-20-O-(肉桂酸酯)-喜樹堿衍生物的抗腫瘤活性評價及其機制研究:本研究以課題組發現的高活性10-氟喜樹堿為先導,設計合成了一系列新型7-乙基-10-氟-20-O-(肉桂酸酯)-喜樹堿衍生物,并對多種腫瘤細胞系進行了細胞毒性評估,包括HepG2(肝細胞癌)、SW480(結直腸癌)、A2780(卵巢癌)和Hucct1(肝內膽管癌)等。體外細胞毒性試驗結果表明,大多數喜樹堿衍生物對受試腫瘤細胞系具有良好的細胞毒性活性。其中,化合物XJS-11對HepG2、SW480、A2780和Hucct1細胞株表現出廣譜抑制活性,IC50值分別為0.03、0.09、0.22和0.32 μM。進一步研究表明,與陽性對照拓撲替康相比,化合物XJS-11對多種人類肝癌細胞(Sk-hep-1、Hep3B和Huh7)具有更有效的生長抑制作用,對永生化正常人類肝細胞系L02的細胞毒性更低。尤其是XJS-11對兩種人肝癌細胞和永生化正常人肝細胞系(IC50(L-02)/IC50(HepG2)=113.20);IC50(L-02)/IC50(Hep3B)=85.60)比拓撲替康(IC50(L-02)/IC50(HepG2)=9.45;IC50(L-02)/IC50(Hep3B)=8.52)顯示出更高的選擇性毒性。在機制上,XJS-11可以類似拓撲替康的方式抑制Top I活性,誘導HepG2和Hep3B細胞的細胞周期阻滯和細胞凋亡。同時,XJS-11可以抑制異種移植和原發性肝癌小鼠模型中的腫瘤生長。此外,急性毒性試驗表明,單次腹腔注射劑量為100 mg/kg或連續7天腹腔注射劑量為25 mg/kg,XJS-11均不會造成致命性或顯著體重減輕。與拓撲替康不同,XJS-11對C57BL/6小鼠的肝臟、腎臟和造血系統沒有明顯毒性。該研究表明:XJS-11可作為新一代喜樹堿候選先導來開發。
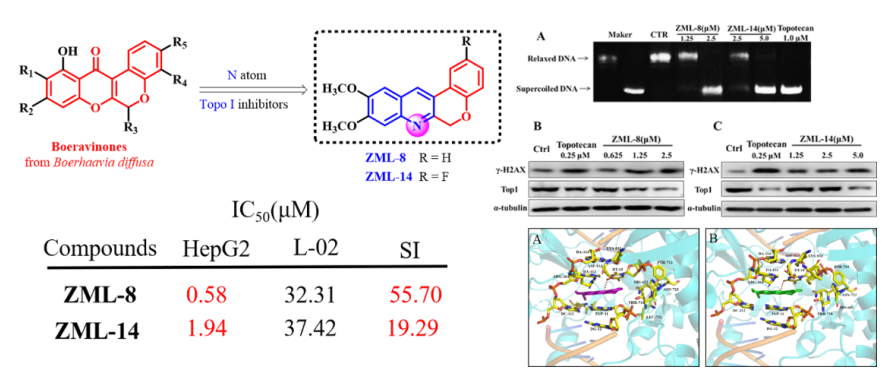
(5)代表性成果-5:Aza-boeravinone衍生物的抗腫瘤活性評價與作用機制研究:基于天然產物boeravinones的結構骨架,該團隊采用“生物電子等排”和“Aza”結構優化策略設計合成了兩個系列的6H-色烯并[3,4-b]喹啉衍生物,并且進一步評估了合成化合物對HepG2、A2780、Hela、HCT116、SW1990和MCF7等多種腫瘤細胞株的細胞毒活性。細胞毒活性篩選結果表明,化合物ZML-8和ZML-14對HepG2具有顯著的抑制效果,IC50值分別為0.58 μM和1.94 μM。此外,化合物ZML-8和ZML-14對HepG2和L-02細胞的選擇性高于對照藥Topotecan。細胞機制研究表明,化合物ZML-8和ZML-14誘導HepG2細胞周期G2/M期阻滯、細胞凋亡和DNA損傷。此外,化合物ZML-8和ZML-14顯著抑制Top I的酶活性,并且誘導Top I蛋白水平的降解。分子對接表明,化合物ZML-8和ZML-14顯著的細胞毒活性是由于與Top1-DNA 復合物的良好相互作用。綜上所述,化合物ZML-8和ZML-14作為用于治療癌癥的新一代非喜樹堿拓撲異構酶I抑制劑,值得進一步開發。
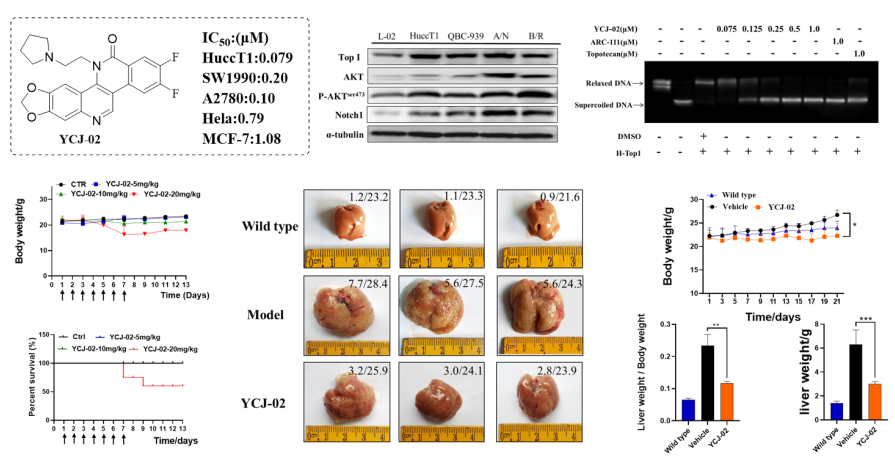
(6)代表性成果-6:雙氟取代的ARC-111衍生物YCJ-02在肝內膽管癌(ICC)中的抗腫瘤活性評價及作用機制研究:本研究圍繞苯并萘啶酮類化合物進行了廣泛的構效關系(SAR)研究,并設計合成了一系列雙氟取代的ARC-111衍生物。其中,化合物YCJ-02具有廣譜的抗腫瘤活性,尤其對ICC細胞系HuccT1具有顯著的抑制活性,IC50值為0.079 μM,且活性優于對照藥ARC-111(0.12 μM)和Topotecan(0.46 μM)。因此,進一步評估了YCJ-02在體外抑制ICC細胞生長的潛力,并通過AKT/NICD誘導的原位小鼠ICC腫瘤模型驗證其在體內的抗腫瘤活性。研究結果表明:Top I在ICC臨床樣本和細胞系中顯著高表達,并且敲除Top I抑制ICC細胞的生長。YCJ-02顯著抑制ICC細胞的增殖,且活性優于對照藥ARC-111和Topotecan。YCJ-02誘導細胞周期G2/M期阻滯并增加p21、p53的表達;YCJ-02誘導細胞凋亡并伴隨著Bax、Bad和Cleaved-caspase3的激活以及Bcl-2的降低;YCJ-02還通過增加γ-H2AX的表達誘導DNA損傷。YCJ-02可以抑制Top I的酶活性并通過蛋白酶體系統誘導其降解。YCJ-02顯著抑制AKT/Notch誘導的小鼠原位ICC腫瘤生長并降低CK19、Ki-67、p-AKTser473、Notch1和Top I的表達。總之,YCJ-02是一個高效的Top I抑制劑,并且可能成為一個治療ICC的有效藥物,為以后的臨床評估提供了一種合理的新型治療策略。
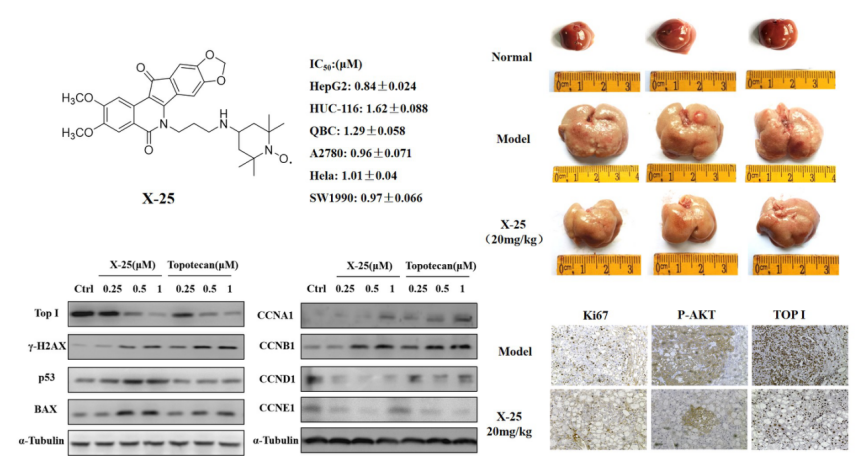
(7)代表性成果-7:穩定氮氧自由基標記的茚并異喹啉類化合物的結構優化與抗腫瘤活性研究:本研究在茚并異喹啉類分子構效關系的基礎上,通過在內酰胺側鏈上的酰胺鍵引入氮氧自由基分子的策略設計合成了一系列穩定氮氧自由基標記的茚并異喹啉類衍生物。細胞毒性篩選結果表明,化合物X-25具有廣譜的抗腫瘤活性,對HepG2、HCT-116、QBC-939、A2780、HeLa和SW1990的IC50分別為0.84 μM、1.62 μM、1.29 μM、0.96 μM、1.01 μM和0.97 μM。進一步的細胞機制研究表明,化合物X-25誘導HepG2細胞周期G/M期阻滯和細胞凋亡。此外,化合物X-25降低Top I的蛋白表達水平和通過增加γ-H2AX的表達誘導DNA損傷。體內研究結果表明,化合物X-25顯著抑制了AKT/Ras誘導的小鼠原位HCC的生長,肝重和肝重比顯著降低,且未見明顯體重下降。這些結果表明,化合物X-25是一種潛在的非喜樹堿類Top I候選藥物,值得進一步研究和開發。
總結:
綜上所述,課題組近年來以喜樹堿類生物堿及非喜樹堿類Top I抑制劑為先導,經優化獲得了多個具開發前景的候選先導,研究取得的系列成果及重要進展為后續開發具有完整自主知識產權的抗腫瘤藥物奠定基礎,其發現的高活性先導分子有望開發為具有自主知識產權的全新抗腫瘤候選藥劑。 研究工作得到了國家重點研發計劃、國家自然科學基金、浙江省優勢特色學科重點項目、甘肅省國際科技合作重點項目等項目的共同資助。該項研究也是課題組近年來依托甘肅省中藏藥功效物質開發與利用行業技術中心,開展源于天然源中藏藥資源進行全新抗腫瘤藥物開發研究取得的一系列重要科研成果,對于推動中藏藥功效物質開發與新藥創制具有重要意義。
代表性文獻導讀:
[1] Mei-Juan Wang, Ying-Qian Liu,* Ling-Chu Chang, Chih-Ya Wang, Yong-Long Zhao, Xiao-Bo Zhao, Keduo Qian, Xiang Nan, Liu Yang, Xiao-Ming Yang, Hsin-Yi Hung, Jai-Sing Yang, Daih-Huang Kuo, Masuo Goto, Susan L. Morris-Natschke, Shiow-Lin Pan, Che-Ming Teng, Sheng-Chu Kuo, Tian-Shung Wu, Yang-Chang Wu, Kuo-Hsiung Lee*. Design, Synthesis, Mechanisms of Action, and Toxicity of Novel 20(S)-Sulfonylamidine Derivatives of Camptothecin as Potent Antitumor Agents. J. Med. Chem. 2014, 57, 6008~6018.
[2] Xiao-Bo Zhao, Dan Wu, Mei-Juan Wang, Masuo Goto, Susan L. Morris-Natschke, Ying-Qian Liu*, Xiao-Bing Wu, Zi-Long Song, Gao-Xiang Zhu, Kuo-Hsiung Lee*. Design and synthesis of novel spin-labeled camptothecin derivatives as potent cytotoxic agents. Bioorg. Med. Chem. Lett. 2014, 22, 6453~6458.
[3] Xiao-Bo Zhao, Masuo Goto, Zi-Long Song, Susan L. Morris-Natschke, Yu Zhao, Dan Wu, Liu Yang, Shu-Gang Li, Ying-Qian Liu*, Gao-Xiang Zhu, Xiao-Bing Wu, Kuo-Hsiung Lee*. Design and synthesis of new 7-(N-substituted-methyl)-camptothecin derivatives as potent cytotoxic agents. Bioorg. Med. Chem. Lett. 2014, 24, 3850~3853.
[4] Ying-Qian Liu, Wen-Qun Li, Susan L. Morris-Natschke, Keduo Qian, Liu Yang, Gao-Xiang Zhu, Xiao-Bing Wu, An-Liang Chen, Shao-Yong Zhang, Xiang Nan, Kuo-Hsiung Lee*. Perspectives on Biologically Active Camptothecin Derivatives. Med. Res. Rev. 2015, 35, 753-789.
[5] Zi-Long Song, Hai-Le Chen, Yu-Han Wang, Masuo Goto, Wen-Jing Gao, Pi-Le Cheng, Susan L. Morris-Natschke, Ying-Qian Liu*, Gao-Xiang Zhu, Mei-Juan Wang, Kuo-Hsiung Lee*. Design and synthesis of novel PEG-conjugated 20(S)-camptothecin sulfonylamidine derivatives with potent in vitro antitumor activity via Cu-catalyzed three-component reaction. Bioorg. Med. Chem. Lett. 2015, 25, 2690~2693.
[6] Zi-Long Song, Mei-Juan Wang, Lanlan Li, Dan Wu, Yu-Han Wang, Li-Ting Yan, Susan L. Morris-Natschke, Ying-Qian Liu*, Yong-Long Zhao, Chih-Ya Wang, Huan-xiang Liu*, Masuo Goto, Heng Liu, Gao-Xiang Zhu, Kuo-Hsiung Lee*. Design, synthesis, cytotoxic activity and molecular docking studies of new 20(S)-sulfonylamidine camptothecin derivatives. Europ. J. Med. Chem. 2016, 115, 109~120.
[7] Cheng-Jie Yang, Zi-Long Song, Masuo Goto, Pei-Ling Hsu, Xiao-Shuai Zhang, Qian-Ru Yang, Ying-Qian Liu*, Mei-Juan Wang, Susan L. Morris-Natschke, Xiao-Fei Shang, Kuo-Hsiung Lee*. Design, semisynthesis and potent cytotoxic activity of novel 10-fluorocamptothecin derivatives. Bioorg. Med. Chem. Lett. 2017, 27, 4694~4697.
[8] Cheng-Jie Yang, Zi-Long Song, Masuo Goto, Ying-Qian Liu*, Kan-Yen Hsieh, Susan L. Morris-Natschke, Yong-Long Zhao, Jun-Xiang Zhang, Kuo-Hsiung Lee*. Design, synthesis, and cytotoxic activity of novel 7-substituted camptothecin derivatives incorporating piperazinyl-sulfonylamidine moieties. Bioorg. Med. Chem. Lett. 2017, 27, 3959~3962.
[9] Gao-Xiang Zhu, Pi-Le Cheng, Masuo Goto, Na Zhang, Susan L. Morris-Natschke, Kan-Yen Hsieh,Guan-Zhou Yang, Qian-Ru Yang, Ying-Qian Liu*, Hai-Le Chen, Xiao-Shuai Zhang, Kuo-Hsiung Lee*. Design, synthesis and potent cytotoxic activity of novel 7-( N -[(substituted-sulfonyl)piperazinyl]-methyl)-camptothecin derivatives. Bioorg. Med. Chem. Lett. 2017, 27, 1750~1753.
[10] Jia You, Yuyuan Chen, Zubaeda M. Mohamed Alsayeh, Xing-yu Shen, Chun Li, Peng-xuan Zhao, Fei Chen, Ying-qian Liu*, Chuan-rui Xu. Nanocrystals of a new camptothecin derivative WCN-21 enhance its solubility and efficacy. Oncotarget, 2017, 8, 29808~29822.
[11] Cheng-Jie Yang, Bin Li, Zhi-Jun Zhang, Jian-Mei Gao, Mei-Juan Wang, Xiao-Bo Zhao, Zi-Long Song, Ying-Qian Liu*, Hu Li, Yu-yuan Chen, Kuo-Hsiung Lee, Susan L. Morris-Natschke, Chuan-rui Xu. Design, synthesis and antineoplastic activity of novel 20(S)-acylthiourea derivatives of camptothecin. Europ. J. Med. Chem. 2020, 187, 111971.
[12] Yu-Yuan Chen,Yin-Peng Bai, Bin Li, Xiao-Bo Zhao, Cheng-Jie Yang, Ying-Qian Liu*, Jian-Mei Gao, Jun Guo, Chun Li, Jing-Wen Peng, Zhong-Min Zhao, Zhi-Jun Zhang, Chuan-Rui Xu*. Design and synthesis of novel 20(S)-α-aminophosphonate derivatives of camptothecin as potent antitumor agents. Bioorg. Chem. 2021, 114, 105065.
[13] Yun-Hao Ma, Wan-Tong Ma, Zhong-Kun Zhou, Xiu Huang, Xin-Rong Jiang, Kang-Jia Du, Meng-Ze Sun, Hao Zhang,Hong Fang, Yi Zhao, Hong-Mei Zhu, Huan-Xiang Liu, Peng Chen*,Ying-Qian Liu*.Synthesis of 8-Fluoroneocryptolepine and Evaluation for Cytotoxic Activity against AGS Cancer Cells. J. Nat. Prod. 2022, 85, 963~971.
[14] Yong Zhou, Yin-Peng Bai, Mi Zhang, Jian-Mei Gao, Cheng-Jie Yang, Zhi-Jun Zhang*, Nan Deng, Lei Li, Ying-Qian Liu*, Chuanrui Xu,*. Design and Synthesis of Aza-boeravinone Derivatives as Potential novel Topoisomerase I Inhibitors. Bioorg. Chem. 2022, 122, 105747.
[15] Yin-Peng Bai, Cheng-Jie Yang, Nan Deng, Mi Zhang, Zhi-Jun Zhang*, Lei Li, Yong Zhou, Xiong-Fei Luo, Chuan-Rui Xu*, Bao-Qi Zhang, Yue Ma, Ying-qian Liu*. Design and Synthesis of Novel 7-Ethyl-10-Fluoro-20-O-(Cinnamic Acid Ester)-Camptothecin Derivatives as Potential High Selectivity and Low Toxicity Topoisomerase I inhibitors for Hepatocellular Carcinoma. Biochem. Pharmacol. 2022, DOI: 10.1016/j.bcp.2022.115049.
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn