- 首頁
- 資訊
中國科學(xué)技術(shù)大學(xué)王細(xì)勝教授課題組JACS:對映選擇性合成β-三氟甲基二級醇
來源:化學(xué)加網(wǎng) 2022-04-19
導(dǎo)讀:近日,中國科學(xué)技術(shù)大學(xué)王細(xì)勝教授課題組首次報(bào)道了一種鎳催化酰氯的不對稱還原交叉偶聯(lián)三氟烷基化反應(yīng),實(shí)現(xiàn)了一系列α-三氟甲基化酮的對映選擇性合成。同時(shí),將其用以一鍋法還原反應(yīng),可獲得具有β-CF3-取代立體碳中心的醇衍生物,且具有優(yōu)異的非對映和對映選擇性。此外,該反應(yīng)具有反應(yīng)條件溫和、官能團(tuán)兼容性良好、收率良好、對映選擇性出色等特點(diǎn)。值得注意的是,通過對生物活性分子的后期修飾,進(jìn)一步證明了反應(yīng)的實(shí)用性。文章鏈接DOI:10.1021/jacs.2c01422
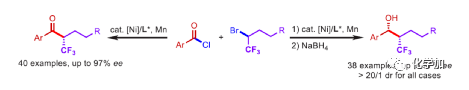
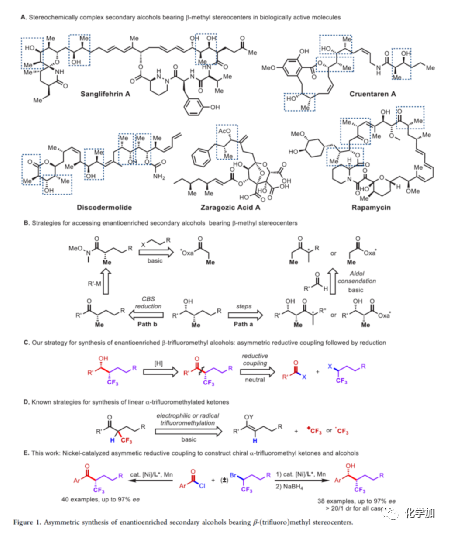
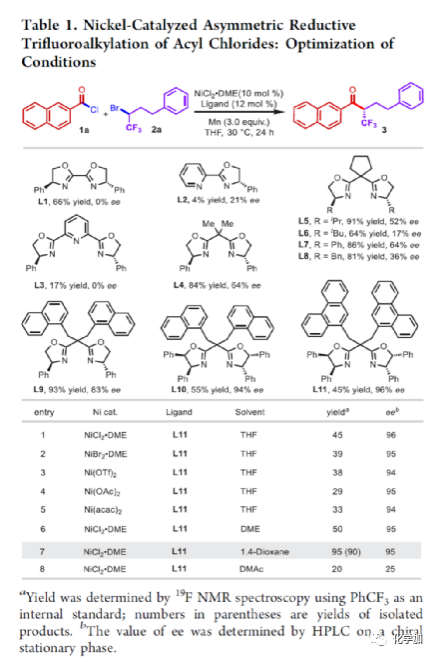
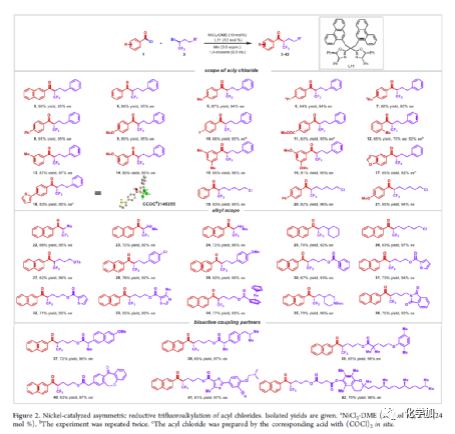
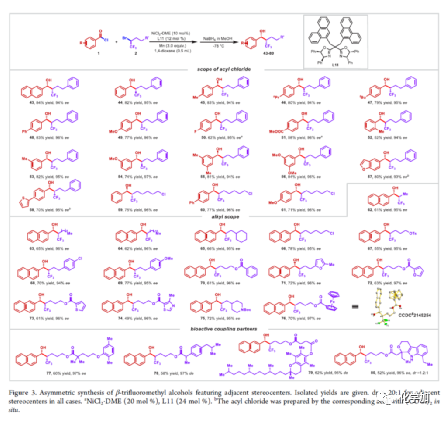
在過去的幾十年中,手性藥物分子的構(gòu)建備受關(guān)注。由于手性分子和外消旋體的對映異構(gòu)體之間的分子間相互作用存在差異,因此手性藥物的對映異構(gòu)體可導(dǎo)致藥效、藥代動力學(xué)甚至毒性等活性出現(xiàn)明顯的差異。同時(shí),將氟原子引入至化合物中,氟對類藥物分子的生物活性產(chǎn)生了獨(dú)特的影響。與已知的芳烴氟化或氟烷基化反應(yīng)相比,對于通過不對稱策略構(gòu)建此類化合物的有效方法卻很少被研究。其中,烴類的氟化反應(yīng)是構(gòu)建手性脂肪族氟化物的主要方法,若將三氟甲基基團(tuán)引入分子中,常需要使用氧化/腐蝕性的親電三氟甲基源(Togni、Umemoto試劑等)。同時(shí),含有β-甲基立體中心的二級醇結(jié)構(gòu)單元廣泛存在于各種生物活性天然產(chǎn)物和藥物中(Figure 1A)。因此,許多課題組已開發(fā)出多種用于構(gòu)建此類分子的不對稱合成方法,如醛的不對稱aldol縮合反應(yīng)與不對稱烷基化/CBS還原的方法(Figure 1B)。迄今為止,對于具有β-CF3-取代立體碳中心的醇衍生物的不對稱方法,仍有待進(jìn)一步探索。下載化學(xué)加APP,閱讀更有效率。(手機(jī)上如何查詢化合物分子式、結(jié)構(gòu)式、制備方法、合成路線、圖譜信息、供應(yīng)商?)考慮到空間位阻更大的三氟甲基可以有效的控制手性α-三氟甲基酮的非對映選擇性還原,王劍波課題組假設(shè),是否可將不對稱偶聯(lián)與還原反應(yīng)相結(jié)合,從而實(shí)現(xiàn)對映體富集β-CF3-取代的醇衍生物的合成(Figure 1C)。然而,由于存在酸性的α-氫原子,酮-烯醇互變異構(gòu)體通過傳統(tǒng)的親電或自由基三氟甲基化反應(yīng),僅獲得外消旋或?qū)τ尺x擇性差的α-三氟甲基酮衍生物(Figure 1D)。因此,對于β-三氟甲基醇分子的對映選擇性構(gòu)建也存在此類問題。近日,王劍波課題組報(bào)道了一種ScIII催化的同系化反應(yīng),從而實(shí)現(xiàn)了α-三氟甲基環(huán)庚酮分子的對映選擇性合成,其中使用2,2,2-三氟重氮乙烷作為CF3源。在此,中國科學(xué)技術(shù)大學(xué)王細(xì)勝教授課題組報(bào)道了一種鎳催化酰氯的不對稱還原交叉偶聯(lián)三氟烷基化反應(yīng),而合成了一系列對映體富集的α-三氟甲基酮衍生物。同時(shí),將其用以一鍋法還原反應(yīng),可獲得具有β-CF3-取代的立體碳中心醇衍生物。值得注意的是,上述的策略具有優(yōu)異的立體化學(xué)選擇性、溫和的反應(yīng)條件、良好的官能團(tuán)兼容性等特點(diǎn),并可用于多種生物活性分子的后期修飾(Figure 1E)。首先,作者以2-萘甲酰氯1a與外消旋的三氟甲基化烷基溴2a作為模型底物,進(jìn)行了相關(guān)不對稱還原三氟烷基化反應(yīng)條件的篩選(Table 1)。當(dāng)以NiCl2·DME作為催化劑,L11作為配體,Mn粉作為還原劑,在1,4-二氧六環(huán)溶劑中反應(yīng),能以90%的收率和95%ee獲得產(chǎn)物3。在獲得上述最佳反應(yīng)條件后,作者對不對稱還原三氟烷基化反應(yīng)的底物范圍進(jìn)行了擴(kuò)展(Figure 2)。首先,苯甲酰氯的芳基對/間上含有一系列供電子與電中性基團(tuán)時(shí),均可順利反應(yīng),獲得相應(yīng)的產(chǎn)物3-9、13-17與19-21,收率為80-91%,ee為94-97%。對于苯甲酰氯的芳基對位含有吸電子基團(tuán)時(shí),反應(yīng)的收率有所下降,但對映選擇性不受影響,如10-11。由于空間位阻的原因,鄰甲基取代的苯甲酰氯,收率與對映選擇性均受影響,如12。然而,對于芳基上含有它雜環(huán)取代的苯甲酰氯,僅有對位含有噻吩基取代的底物,獲得優(yōu)異收率與對映選擇性的產(chǎn)物18,其余反應(yīng)性均較差。其次,一系列不同取代的三氟烷基溴化物,在上述的條件下,均可順利進(jìn)行反應(yīng),獲得相應(yīng)的產(chǎn)物22-36,收率為55-83%,ee為90-97%。其中,對于不含任何雜原子的簡單烷基鏈的三氟烷基溴(22-25)以及烷基鏈末端含有氯或甲苯磺酸酯基的三氟烷基溴(26-27),均與體系兼容。芳基上具有不同電性的取代基以及雜環(huán)芳烴衍生的三氟烷基溴底物(28-29和31-33),均可順利進(jìn)行反應(yīng)。此外,該策略還可用于生物活性分子的后期修飾,如萘普生(37)、(S)-布洛芬(38)、吉非羅齊(39)、伊索克酸(40)、非布司他(41)、維生素E(42)。緊接著,作者發(fā)現(xiàn),上述合成的α-三氟甲基化酮通過NaBH4還原,可進(jìn)一步獲得一系列手性β-三氟甲基醇衍生物43-80,具有中等至良好的收率、出色的對映選擇性與非對映選擇性(Figure 3)。因此,通過兩步一鍋法可快速合成一系列手性β-三氟甲基醇衍生物。令人驚訝的是,當(dāng)使用鄰甲基苯甲酰氯和三氟烷基溴進(jìn)行不對稱偶聯(lián)反應(yīng)時(shí),獲得收率偏低的產(chǎn)物52(52%),但對映選擇性不受影響(94%)。總結(jié):中國科學(xué)技術(shù)大學(xué)王細(xì)勝教授課題組報(bào)道了一種高效且通用的鎳催化酰氯的不對稱還原性交叉偶聯(lián)三氟烷基化反應(yīng),實(shí)現(xiàn)了一系列手性α-三氟甲基化酮的對映選擇性合成。同時(shí),通過兩步一鍋法的策略,可獲得具有β-CF3-取代的立體碳中心醇衍生物。此外,該反應(yīng)具有反應(yīng)條件溫和、官能團(tuán)兼容性良好、收率高、對映/非對映選擇性出色等特點(diǎn)。值得注意的是,通過對生物活性分子的后期修飾,從而進(jìn)一步證明了反應(yīng)的實(shí)用性。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn