



肝臟是人體內(nèi)以代謝功能為主的一個重要器官。而生活中許多原因都容易導(dǎo)致肝損傷,現(xiàn)代快節(jié)奏的生活也加劇了肝損傷,肝損傷后期極易發(fā)展成為肝硬化及肝癌,嚴(yán)重威脅人類健康。然而,目前臨床抗肝損傷藥物較少,開發(fā)新的抗肝損傷藥物成為治療肝損傷的需求迫切。
孫宇輝教授課題組前期在微生物活性天然產(chǎn)物的挖掘過程中,從武漢大學(xué)校園土壤中分離到的一株鏈霉菌(Streptomyces spectabilis CCTCC M2017417)中發(fā)現(xiàn)了一類具有抗耐甲氧西林金黃色葡萄球菌(Methicillin-resistant Staphylococcus aureus, MRSA)活性的萘安莎類抗生素曲張鏈絲菌素(Streptovaricins),并對參與曲張鏈絲菌素的多個細(xì)胞色素P450酶編碼基因進(jìn)行了全面探索(ACS Chemical Biology, 2017, 12: 2589-2597),揭示了與其中亞甲基雙氧橋結(jié)構(gòu)相關(guān)的生物合成機(jī)制(Nature Communications, 2020, 11: 4501)。在對這一菌株活性次生代謝產(chǎn)物的進(jìn)一步挖掘過程中,重新分離獲得了媲美一線抗肝損傷臨床藥物水飛薊素的活性先導(dǎo)化合物Hangtaimycin,并糾正了其立體化學(xué)構(gòu)型。通過對Hangtaimycin的結(jié)構(gòu)及其生物合成基因簇生物信息學(xué)分析,發(fā)現(xiàn)Hangtaimycin的碳骨架化學(xué)結(jié)構(gòu)與催化其生物合成的PKS結(jié)構(gòu)域(Domain)功能之間存在非經(jīng)典線性對應(yīng),其中HtmA1中四個模塊(Module)僅負(fù)責(zé)催化兩輪碳鏈延伸。通過與Jeroen S. Dickschat教授課題組,以及藥學(xué)院沈坤副研究員、項瑾副教授團(tuán)隊合作,運用體內(nèi)遺傳失活、底物化學(xué)合成及體外生化重建等方法,證明模塊1僅負(fù)責(zé)一個不飽和雙鍵單元的延伸,模塊2模塊3以非典型共線性脫水雙模塊的方式,共同催化第二個Z型雙鍵的形成。
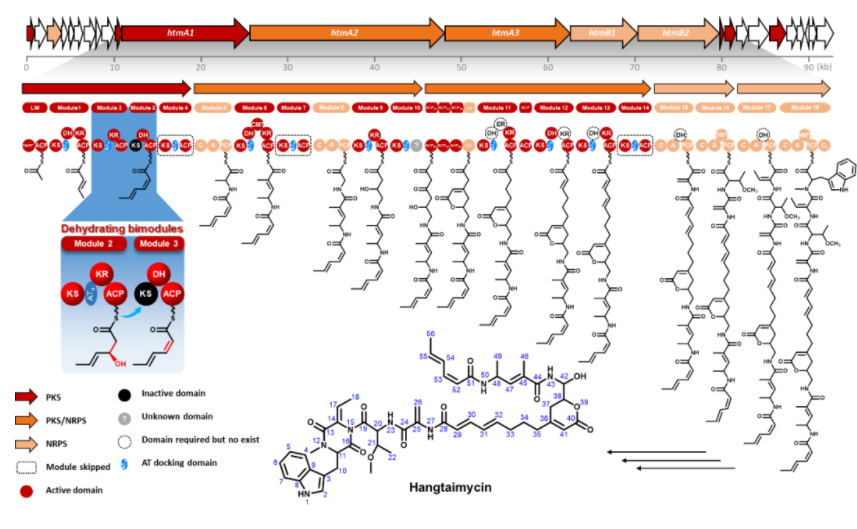
在經(jīng)典的I型PKS催化聚酮碳鏈骨架生物合成過程中,PKS模塊和結(jié)構(gòu)域的數(shù)量和功能與其所催化形成的相應(yīng)化學(xué)結(jié)構(gòu)之間存在著嚴(yán)格的線性對應(yīng)關(guān)系,即聚酮鏈合成的底物選擇、還原程度和產(chǎn)物的立體化學(xué)構(gòu)型都是由PKS上相應(yīng)模塊中的結(jié)構(gòu)域所決定,通過對酮基選擇性地還原和脫水,從而在終產(chǎn)物的相應(yīng)位置形成酮基、羥基、雙鍵等功能團(tuán),同時還可決定產(chǎn)物手性中心的立體化學(xué)構(gòu)型。盡管之前在PKS中已發(fā)現(xiàn)脫水雙模塊之間可以合作的方式共同催化一個雙鍵的形成,但是本研究首次證實了這一脫水雙模塊的作用方式和機(jī)制。這一發(fā)現(xiàn)有助于進(jìn)一步拓展人們對PKS經(jīng)典的線性裝配模式的認(rèn)知,也為聚酮藥物的人工創(chuàng)新提供新的契機(jī)和靈感。
論文鏈接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202106250
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn