

阿爾茨海默病(Alzheimer's disease,AD),俗稱老年癡呆癥,是一種發病進程緩慢、隨著時間不斷惡化的神經退化性疾病。AD以記憶障礙、失語、失認等為早期主要癥狀,當情況惡化時,患者逐漸喪失身體機能并最終死亡。AD已經成為越來越嚴重的公共衛生問題和社會問題:據國際阿爾茨海默病協會的報告顯示,每3秒鐘,全球就有一位AD患者產生,而我國每年平均有30萬新發病例。2021年3月16日,浙江大學定量生物中心周如鴻教授課題組在國際權威期刊 Chemical Science 發表題為 Molecular Mechanism of Secreted Amyloid-β Precursor Protein in Binding and Modulating GABABR1a 的論文,為相關疾病治療學的未來發展提供了啟示。
AD患者的特征是大腦中存在具有神經毒性的β淀粉樣蛋白 (Aβ) 沉積物。Aβ由淀粉樣蛋白前體蛋白(APP)的正常水解裂解產生。最近的一項驚人研究發現(Science 2019, 363, 143【1】),成熟APP分泌的sAPP的延伸域可與γ-氨基丁酸B型受體1a型亞基(GABABR1a)的固有紊亂的Sushi 1域結合并調節其突觸傳遞。這項工作可能為治療AD開辟新的途徑——不僅通過靶向Aβ,而且通過加強APP的替代切割途徑。然而,其中的詳細分子相互作用機制仍然難以捉摸。
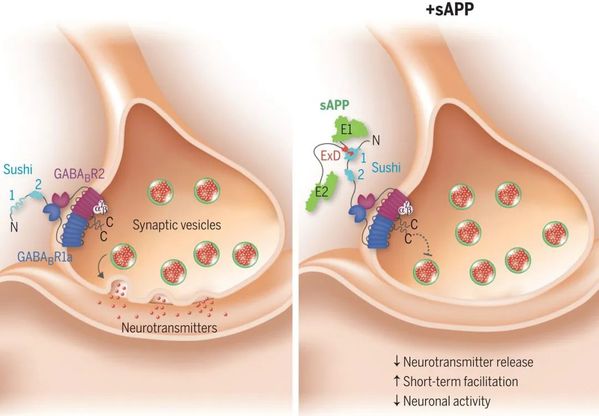
圖1:sAPP是一種功能性GABABR1a特異性配體(圖源:文獻【1】)
在這里,我們使用全原子分子動力學模擬研究了17個殘基sAPP肽(APP 17-mer)及其最低活性的9個殘基片段的sAPP肽(APP 9-mer)與天然非結構化的Sushi 1結構域之間的動力學相互作用。揭示了sAPP肽可用來穩定天然非結構化sushi 1結構域的重要的結構結合模式和主要驅動力,確定了APP 9-mer肽中的三個關鍵結合殘基(D4,W6和W7),并通過計算機誘變研究對其進行了進一步檢查。更重要的是,通過嚴格的自由能微擾(FEP)計算來探索APP 9-mer的突變表明,基于進化過程中不同脊椎動物APP序列的一個雙突變表現出更強的結合力,表明可能是增強的GABABR1a調節劑。
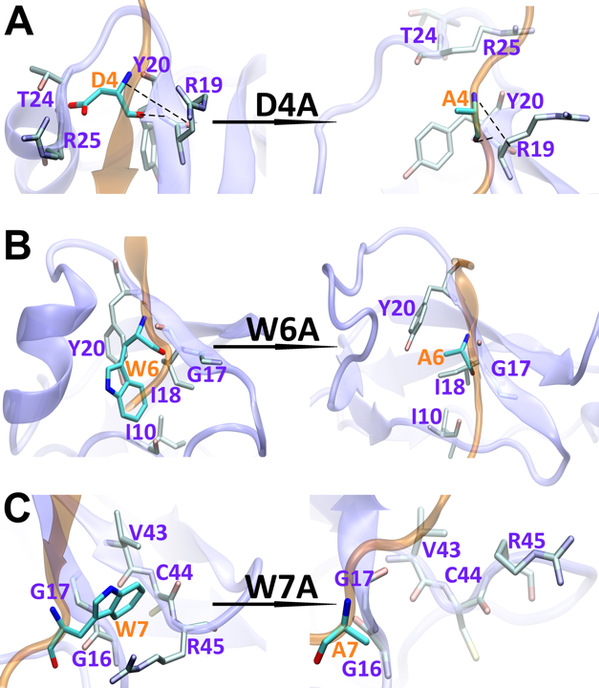
圖2:野生型(左)和突變型(右)APP 9-mer結合sushi 1域的結構比較
這些發現揭示了對App 9mer-sushi 1域結合的新穎見解,這可能為與許多涉及GABABR信號傳導的神經疾病相關的GABABR1a同種型特異性療法的開發提供新的途徑。
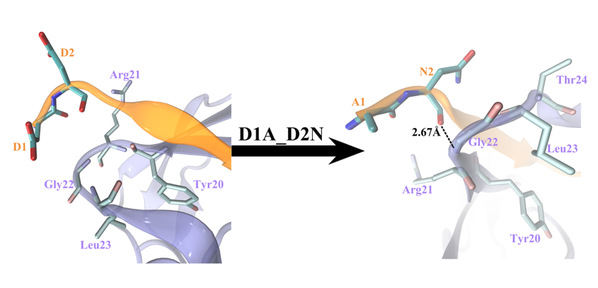
圖3:APP 9-mer雙突變D1AD2N引起的結合復合物結構變化
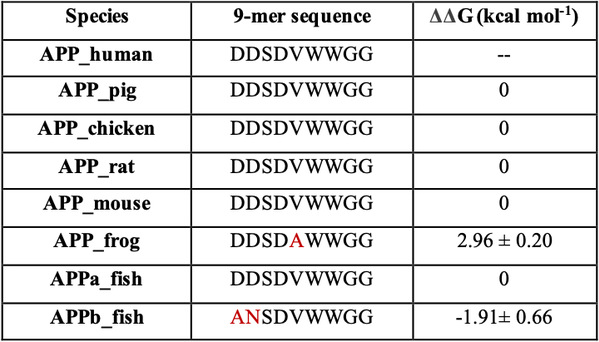
表1:針對其他物種的相應APP 9-mer序列的突變
浙江大學定量生物中心/蘭州大學物理學院青年研究員馮梅和浙江大學物理學系博士生宋伊為論文共同一作,浙江大學周如鴻教授為論文通訊作者。橡樹嶺國家實驗室的Serena H. Chen和康奈爾大學應用數學中心的章元肇也參與了本論文。
這項工作得到了中國國家自然科學基金、國家自主創新示范區上海張江重大專項、中國博士后科學基金,以及W.M. Keck基金會的資助。
原文鏈接:https://doi.org/10.1039/D0SC06946A
參考資料
[1] 生科院周如鴻教授課題組Chemical Science發文為治療AD開辟新途徑http://www.zju.edu.cn/2021/0401/c32861a2273432/page.htm
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn