



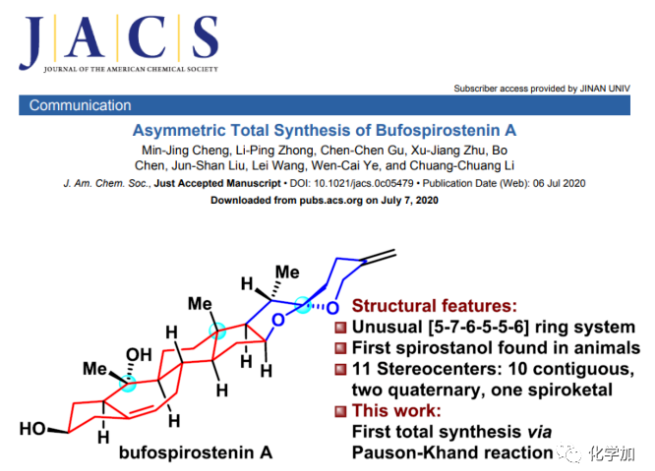
▲圖1. Bufospirostenin A(圖片來(lái)源:J. Am. Chem. Soc.)
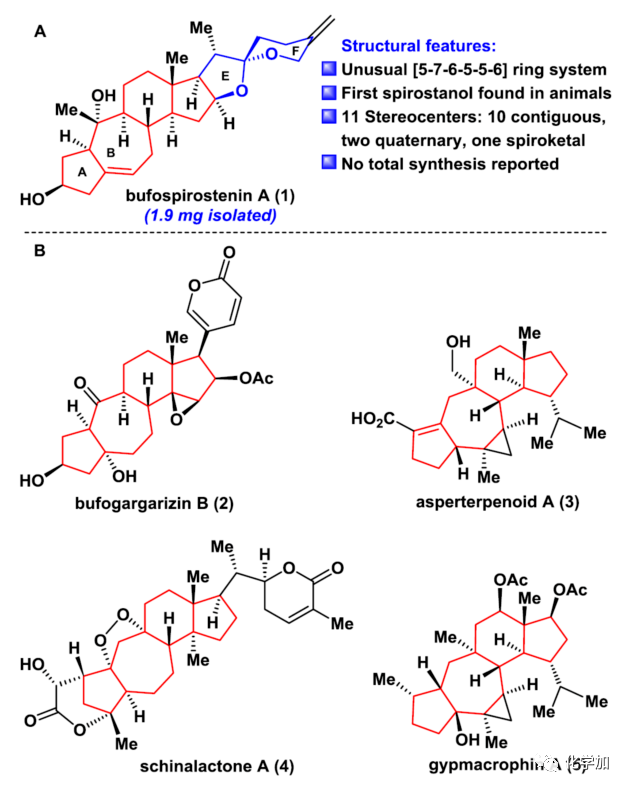
▲ 圖2. Bufospirostenin A的結(jié)構(gòu)特點(diǎn)以及具有[5-7-6-5]骨架的代表性天然產(chǎn)物(圖片來(lái)源:J. Am. Chem. Soc.)
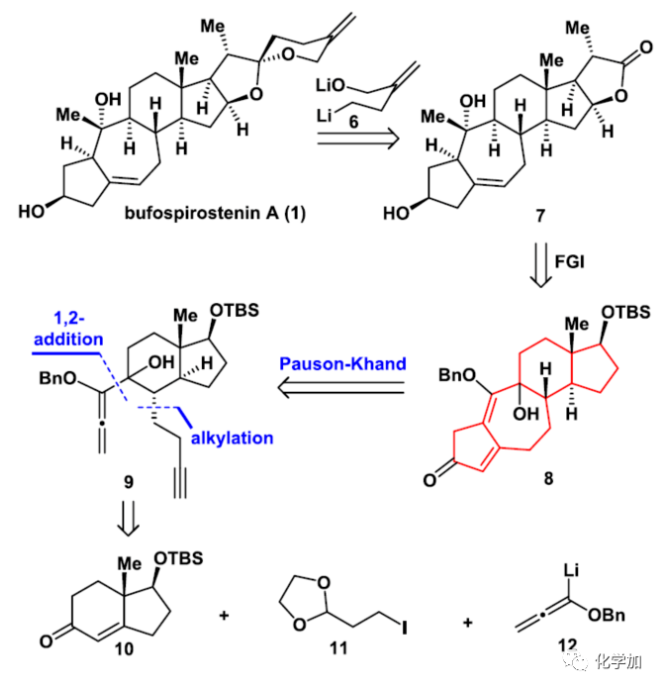
▲圖3. Bufospirostenin A的逆合成分析(圖片來(lái)源:J. Am. Chem. Soc.)
Bufospirostenin A的不對(duì)稱全合成 (圖4-5)
首先(圖4),參考已知文獻(xiàn),作者利用10與碘代物9在NaH/DMSO條件下發(fā)生烷基化反應(yīng),隨后在NiCl2·6H2O/MeOH體系下發(fā)生立體選擇性1,4-還原反應(yīng)得到13 (總收率40%,8 g規(guī)模)。13在CeCl3·7H2O/MeCN存在下脫除縮醛保護(hù),而后發(fā)生Seyferth–Gilbert增碳反應(yīng)制備15 (總收率56%,12 g規(guī)模)。15與12a發(fā)生1,2-加成反應(yīng)制備9 (9a:9b =1:2)。
接著,作者利用9探索了一系列的Pauson–Khand反應(yīng)條件,最終在以[RhCl(CO)2]2為催化劑發(fā)生分之內(nèi)烷氧基聯(lián)烯-炔Pauson–Khand反應(yīng)得到含[5-7-6-5]四環(huán)骨架的8 (8a、8b的絕對(duì)構(gòu)型通過單晶X-射線衍射分析證實(shí)) (2步產(chǎn)率85%,1.4 g規(guī)模)。8經(jīng)過長(zhǎng)期探索,在BF3·Et2O/DCM條件下區(qū)域選擇性消除得到16 (產(chǎn)率81%,1.6 g規(guī)模)。隨后,16經(jīng)過Pd/C、H2區(qū)域和立體選擇性還原C1-C10、C9-C11的雙鍵及DIBAL立體選擇性還原C3位羰基,一鍋法制備17 (產(chǎn)率65%,1.0 g規(guī)模)。17經(jīng)過MOM保護(hù)及Mukaiyama hydration一鍋法制備18。隨后Pd/C、H2脫除Bn保護(hù)基,及PDC氧化一鍋法得到19 (2步產(chǎn)率60%),絕對(duì)構(gòu)型通過單晶X-射線衍射分析證實(shí)
接著(圖5),作者直接利用MeLi或MeMgBr進(jìn)攻19的C10位羰基,未得到手性正確的產(chǎn)物。隨后采用Peterson olefination 反應(yīng)策略制備20 (產(chǎn)率86%,1.4 g規(guī)模)。20經(jīng)過DMP氧化、TMS保護(hù)、Mukaiyama hydration一鍋法制備21 (產(chǎn)率56%),絕對(duì)構(gòu)型通過單晶X-射線衍射分析證實(shí)。接著,21經(jīng)過MOM保護(hù)得到22 (產(chǎn)率93%)。
隨后,作者通過經(jīng)典化學(xué)反應(yīng)如Horner-Wadsworth-Emmons olefination、甲基化、硼氫化氧化、DMP氧化、Pinnick氧化、酯化反應(yīng)制備24 (4步產(chǎn)率34.5%)。接下來(lái),24通過NaBH4還原及TBAF脫除TMS保護(hù)基一鍋法制備內(nèi)酯25 (產(chǎn)率65%)。最后,25在SOCl2/Pyr.條件下消除叔醇羥基,隨后與26發(fā)生1,2-加成反應(yīng),最后加入HCl兩步得到Bufospirostenin A (1) (2步產(chǎn)率30%)。
在完成Bufospirostenin A的全合成后,李闖創(chuàng)團(tuán)隊(duì)與暨南大學(xué)葉文才團(tuán)隊(duì)等繼續(xù)合作,進(jìn)一步開展對(duì)其生物活性的研究。研究表明,Bufospirostenin A分子在轉(zhuǎn)基因斑馬魚體內(nèi)的炎癥部位能顯著的降低中性粒細(xì)胞數(shù)(2.5–10 μM)。這表明Bufospirostenin A具有良好的抗炎活性,因此Bufospirostenin A具有成為抗炎新藥先導(dǎo)化合物的潛力。
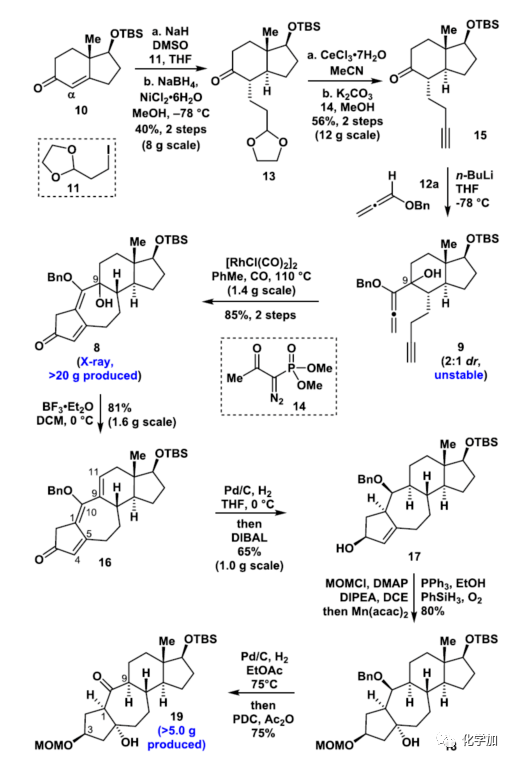
▲圖4. 關(guān)鍵中間體19的不對(duì)稱合成(圖片來(lái)源:J. Am. Chem. Soc.)
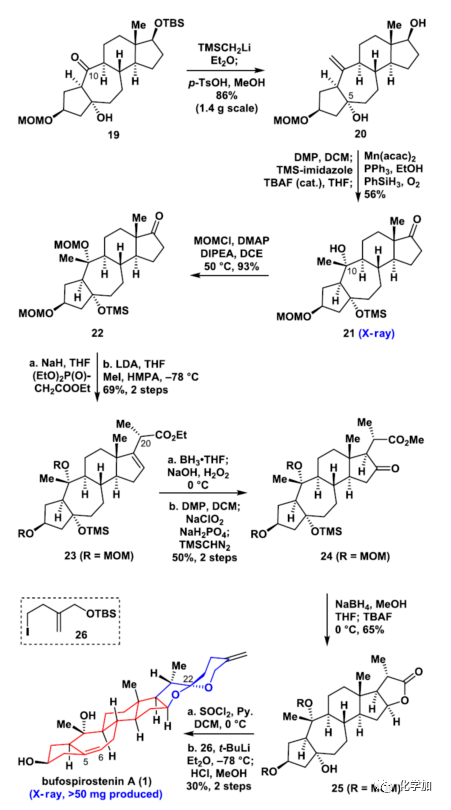
▲圖5. Bufospirostenin A的不對(duì)稱全合成(圖片來(lái)源:J. Am. Chem. Soc.)
總結(jié):李闖創(chuàng)教授團(tuán)隊(duì)與葉文才教授團(tuán)隊(duì)等合作,從已知化合物出發(fā),通過20步,完成了復(fù)雜甾體Bufospirostenin A的首次不對(duì)稱全合成。其工作亮點(diǎn)在于:通過分之內(nèi)Pauson–Khand反應(yīng)高效快速構(gòu)建[5-7-6-5]四環(huán)骨架,該骨架類型同樣存在其他天然產(chǎn)物中;這也是烷氧基聯(lián)烯-炔參與的Pauson–Khand反應(yīng)首次應(yīng)用于天然產(chǎn)物全合成;立體選擇性的構(gòu)建了11個(gè)手性中心,包括10個(gè)連續(xù)的手性中心。該項(xiàng)研究使用的合成方法還可以擴(kuò)展到其他具有[5-7-6-5]核心骨架天然產(chǎn)物的不對(duì)稱合成,為進(jìn)一步的生物學(xué)研究打下了堅(jiān)實(shí)的基礎(chǔ),也為后繼開展創(chuàng)新藥物的進(jìn)一步藥物化學(xué)研究奠定了基礎(chǔ)。
原文鏈接:https://pubs.acs.org/doi/pdf/10.1021/jacs.0c05479
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn