

具有廣泛應用前景的新型Li-CO2電化學儲能系統吸引了廣大科研工作者的研究興趣,其理論能量密度高達1876 Wh kg-1。Li-CO2電池中的可逆電化學反應:4Li + 3CO2 =2Li2CO3 + C (E0 = 2.80 V vs Li/Li+)也是固定CO2的新途徑,其中碳酸鋰(Li2CO3)作為主要放電產物是一種寬帶隙絕緣子。這將導致其在充電過程中的分解動力學變慢,而且高的充電電位加速了電極的氧化和電解質的分解。在循環過程中,Li2CO3的不完全分解和不可逆的形成,以及固體碳酸鹽物質在陰極表面的積累,也會導致電化學性能的明顯下降,直至Li-CO2電池的“猝死”。因此,Li-CO2電池還需要克服許多挑戰才能應用。
尋求高效、堅固的陰極催化劑可以降低Li-CO2電池的高充電電位平臺,提高Li-CO2電池的能效和循環壽命。目前已經對碳(石墨烯和碳納米管)、金屬及其金屬氧化物或碳化物、金屬有機骨架化合物等材料進行廣泛研究。已有的實驗結果發現Li-CO2電池中存在其他電化學反應,如多孔分形Zn作為陰極催化劑時可以觀察到CO;以Au和多孔碳為陰極催化劑時則出現一個新的氧化鋰(Li2O)平臺,同時檢測到了中間產物草酸鋰(Li2C2O4),但在隨后的還原過程中迅速分解為Li2CO3和C;而以Mo2C/CNTs為陰極催化劑時最終放電產物為Li2C2O4。因此,全面了解放電和充電過程中的反應機理,對開發Li-CO2電池和CO2固定技術非常重要。
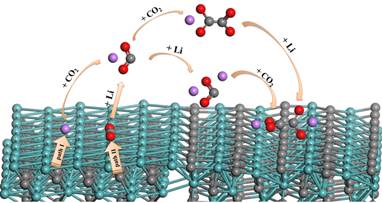
圖1 Mo2C(001)和(101)兩個晶面的兩條最優路徑
湖南大學材料科學與工程學院郭坤琨、袁定旺教授與四川省新材料研究中心王斌、程建麗研究員合作,利用第一性原理密度泛函理論(DFT)計算,首次研究了碳化鉬(Mo2C)作為Li-CO2電池陰極催化劑的反應機理。根據前人的實驗研究,設計了5條不同的反應路徑,計算不同中間產物的吉布斯自由能變化,從中選擇了在三個碳化鉬(Mo2C)晶面的最優反應路徑,見圖1。系統研究了草酸鋰(Li2C2O4)和碳酸鋰(Li2CO3)成核過程中不同中間產物的吉布斯自由能變化,見圖2。理論結果也進一步表明三個碳化鉬(Mo2C)晶面均抑制了草酸鋰(Li2C2O4)分解形成碳酸鋰(Li2CO3)的化學反應。因此,這些研究從理論上證明了Li2C2O4可以作為最終放電產物被穩定下來,從而阻止進一步形成Li2CO3。利用Bader電荷分析研究了吸附在催化表面上的Li2C2O4的表面電荷分布,發現在Li2C2O4和Mo2C表面之間存在電子轉移。這些研究將促進對Li-CO2電池中電化學過程的理解和認識,也為Li-CO2電池陰極催化劑的設計和優化提供直接的理論指導。
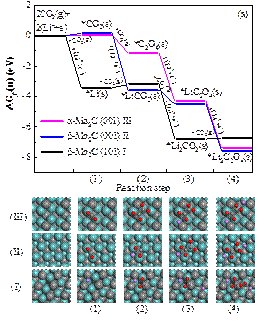
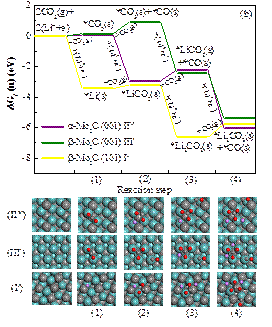
圖2 在開路電壓下,草酸鋰 (a) 和碳酸鋰 (b)在不同碳化鉬晶面的形核能量路徑圖。
相關成果發表在國際頂級期刊《JOURNAL OF THE AMERICAN CHEMICAL SOCIETY》(IF=14.695)上,論文題為" Unraveling Reaction Mechanisms of Mo2C as Cathode Catalyst in Li-CO2 Battery "。湖南大學博士研究生楊超為論文的第一作者,郭坤琨教授為第一通訊作者、袁定旺教授為共同通訊作者。
文章鏈接:https://pubs.acs.org/doi/abs/10.1021/jacs.9b12868
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn