

據介紹,膠囊結構既可有效保護酶不受外部環境的影響,又能賦予內腔中的酶更高的自由度。同時,COFs的孔道設計有效保證了底物的順利傳質。此方法不受生物大分子的尺寸限制,普適性強,且適用于多酶級聯反應。該研究為理解酶在體外的生物催化行為提供指導,為人工細胞器、生物反應器和先進微器件的構建及相關生物醫學應用開辟了新的道路。
固定化技術已經成為促進生物大分子應用的有效途徑。在發揮限域空間保護力的同時,最大限度對生物大分子的結構和活性“保真”,是這一領域亟待解決的挑戰。然而,傳統固定化制劑存在一些缺點,例如,柔性的生物大分子的效能一定程度上有賴于自身的自由度,而包裹率低、泄露、體系的傳質也是困擾此領域的關鍵問題,亟待開發針對上述問題的新型固定化制劑平臺。
受到生命體普遍存在的分區效應的啟發,陳瑤課題組另辟蹊徑,提出了一種用MOFs作為犧牲模板,二次構筑限域空間,制備COFs膠囊封裝生物大分子的新策略。COFs的多孔性、高穩定性和可調節性使其成為固定化制劑的優良載體。然而,其制備過程的苛刻條件阻礙了其生物醫藥應用。而利用多孔材料直接吸附或包裹生物大分子,易將其禁錮,缺乏自由度而導致活性降低、傳質受阻。
陳瑤課題組利用溫和條件下可降解的ZIF-8、ZIF-90等作為犧牲模板,釋放出生物分子而不影響其活性的特點,首先用MOFs對生物分子進行固定,繼而在其外形成COFs外殼,最后在溫和的條件下對MOFs進行降解,對生物分子“松綁”,將其釋放到COFs的內腔中,首次創建了可定制化的生物分子@COF“核殼膠囊反應器”。并用于構建新型生物制劑和多酶級聯催化。被保護的多亞基酶分子(如葡萄糖氧化酶和觸酶)得以被釋放到外層更大的COFs膠囊中,保護的同時賦予其更高自由度,結構和活性得于最大程度“保真”,活力提高超過300%。
為了探究上述制備方法的普適性,陳瑤課題組使用了多種MOFs和COFs材料構筑膠囊結構,并成功調控了具有良好通透性的膠囊的內部空腔大小和壁厚。試驗證明該策略同樣適用于其他生物大分子和多酶級聯體系(活性提高達80%)。
據介紹,該晶態膠囊保護的生物大分子展現出很好的穩定性,其對加熱、有機溶劑、蛋白酶和酸等嚴苛條件處理均表現出耐受性。此外,反復循環利用10次后以上,其活性得以保持。
論文鏈接:https://pubs.acs.org/doi/pdf/10.1021/jacs.0c00285
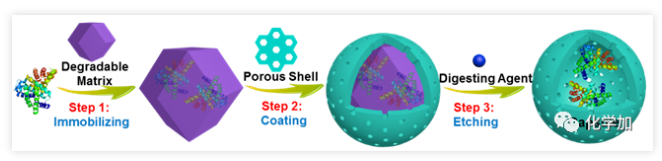
圖1. 三步法制備生物分子@cof膠囊結構的示意圖
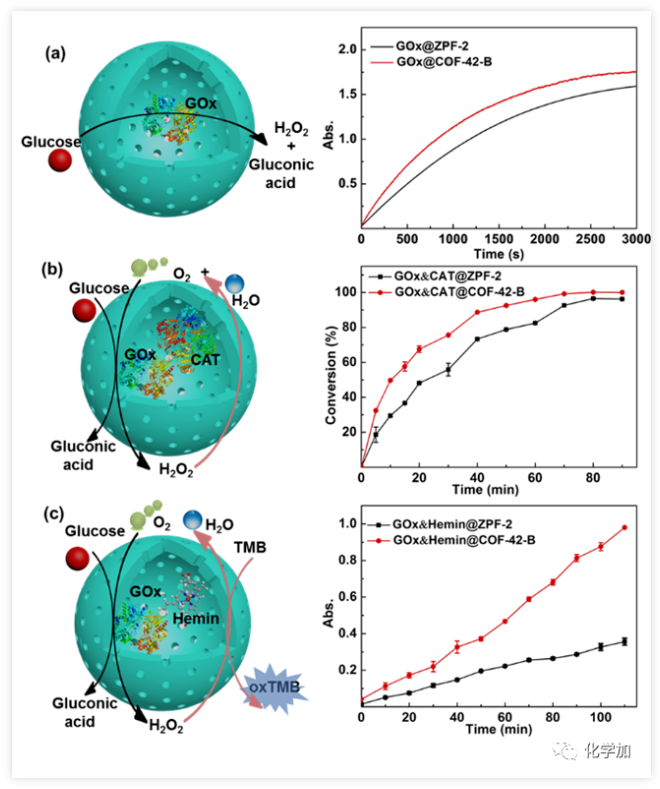
圖2. 酶的催化活性表征。(a)以abts為底物,cyt c聯用的比色法檢測gox@zpf-2和gox@cof-42-b活性;(b)測量葡萄糖的降解來表征goxcat@zpf-2和g
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn