

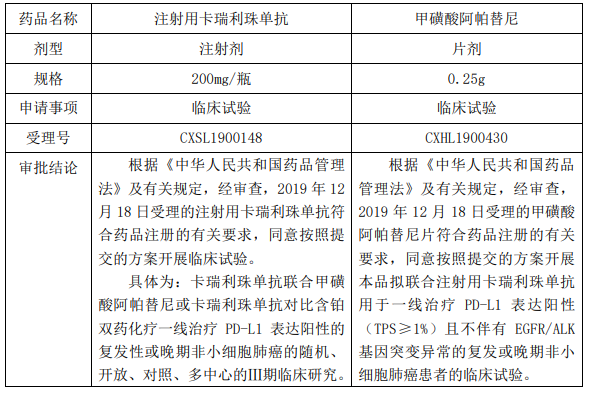
恒瑞醫藥近日收到國家藥品監督管理局核準簽發的注射用卡瑞利珠單抗、甲磺酸阿帕替尼《臨床試驗通知書》,并將于近期開展臨床試驗。

恒瑞醫藥近日收到國家藥品監督管理局核準簽發的注射用卡瑞利珠單抗《藥品注冊批件》。注射用卡瑞利珠單抗是人源化抗 PD-1 單克隆抗體,可與人 PD-1 受體結合并 阻斷 PD-1/PD-L1 通路,恢復機體的抗腫瘤免疫力,從而形成癌癥免疫治療基礎。 2019 年 5 月,注射用卡瑞利珠單抗獲得了復發難治性經典型霍奇金淋巴瘤 的適應癥的上市批準。同時,恒瑞醫藥向國家藥監局提交注射用卡瑞利珠單抗的肝細 胞癌 II 期臨床試驗報告,申請有條件批準上市,獲審評中心承辦并納入優先審評。
經查詢,目前國外有 3 款 PD-1 單克隆抗體獲批上市,分別為帕博利珠單抗(默 沙東,商品名可瑞達),納武利尤單抗(百時美施貴寶,商品名歐狄沃)和 cemiplimab(再生元制藥,商品名 Libtayo)。帕博利珠單抗和納武利尤單抗均已在國內獲批上市。除公司外,國內另有 3 款 PD-1 單克隆抗體獲批上市,分別為特瑞普利單抗(上海君實,商品名拓益,2018 年獲批),信迪利單抗(信達生物,商品名達伯舒,2018 年獲批)和替雷利珠單抗(百濟神州,商品名百澤安,2019 年獲批)。經查詢 IQVIA 數據庫,2019 年抗 PD-1 抗體全球銷售額約為 188.09 億美元。
甲磺酸阿帕替尼是公司創新研發的小分子靶向藥物,2014 年獲批上市。經 查詢,甲磺酸阿帕替尼目前國內外有索拉非尼、舒尼替尼、培唑帕尼等多種同類 產品獲批上市。索拉非尼由拜耳公司開發,最早于 2005 年在美國獲批上市;舒 尼替尼由輝瑞公司開發,最早于 2006 年在美國獲批上市。培唑帕尼由諾華研發, 2009 年在美國獲批上市。目前三款多靶點抑制劑均已在國內獲批上市。2018 年 甲磺酸阿帕替尼銷售額約為 17 億元人民幣。
截至目前,注射用卡瑞利珠單抗、甲磺酸阿帕替尼項目的累計研發費用分別 為 88,658 萬元、33,279 萬元。
根據我國藥品注冊相關的法律法規要求,藥物在獲得臨床試驗通知書后,尚需開展臨床試驗并經國家藥監局審評、審批通過后方可生產上市。
【新華網】卡瑞利珠單抗實現我國晚期肝癌免疫治療新突破
3月6日,江蘇恒瑞醫藥發布公告稱,公司創新藥卡瑞利珠單抗(艾瑞卡)正式獲得國家藥品監督管理局(NMPA)批準,用于接受過索拉非尼治療和/或含奧沙利鉑系統化療的晚期肝細胞癌患者的治療,這是中國首個獲批肝癌適應癥的PD-1抑制劑,標志著我國晚期肝癌免疫治療取得新突破。
我國肝癌發病和死亡形勢嚴峻,且與其他國家不同的是,有相當大一部分肝癌源于乙肝病毒(HBV)感染,且多數患者發現時為中晚期。但是,晚期肝癌的系統性治療藥物有限,國際上尚沒有治療肝癌的免疫治療藥物,我國亟需重點針對“中國肝癌患者”進行新藥開發,為廣大患者提供新的更有效的治療手段。
由解放軍東部戰區總醫院秦叔逵教授和復旦大學附屬中山醫院任正剛教授共同牽頭,卡瑞利珠單抗針對既往系統性治療失敗的中國晚期肝細胞癌的全國多中心II期臨床研究于2016年11月啟動,一共有來自全國13家醫院的220位肝癌患者參與,是截至目前全球首個且樣本量最大的針對中國肝癌患者的免疫檢查點抑制劑臨床研究。研究結果證實,卡瑞利珠單抗體現出了較高的有效率,患者疾病進展后繼續使用該產品仍可獲益,且具有較好的安全性。
該臨床研究結果先后登陸2018年歐洲腫瘤內科學會(ESMO)口頭報告專場和2019年中國臨床腫瘤學會(CSCO)創新藥物臨床研究數據專場。2018年5月原國家藥品審評中心(CDE)將其納入優先審評名單,研究結果于2020年2月26日在《柳葉刀·腫瘤學》(The Lancet Oncology)全文在線發表,這也是中國首個登上柳葉刀的肝癌免疫研究。3月3日,柳葉刀官方微信公眾號又特別邀請作者團隊對論文進行專門介紹,充分表明國際頂級學術界對這一“中國式肝癌治療”的高度關注。同時,卡瑞利珠單抗聯合另一創新藥阿帕替尼的治療方案被列入2019版國家肝癌診療規范。
據悉,除此次獲批的肝癌適應癥外,卡瑞利珠單抗用于復發/難治性霍奇金淋巴瘤的適應癥已于2019年5月獲批,另有晚期食管鱗癌、晚期或轉移性非鱗癌非小細胞肺癌 2個新適應癥申報上市并被納入優先審評。卡瑞利珠單抗聯合阿帕替尼一線治療晚期肝細胞癌III期臨床研究已在美國、俄羅斯、比利時、德國、法國、西班牙、意大利、波蘭、韓國和中國等14個國家和地區、123家中心同步開展。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn