

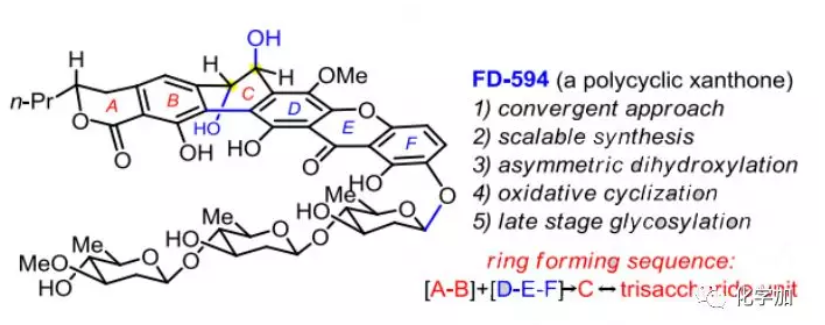
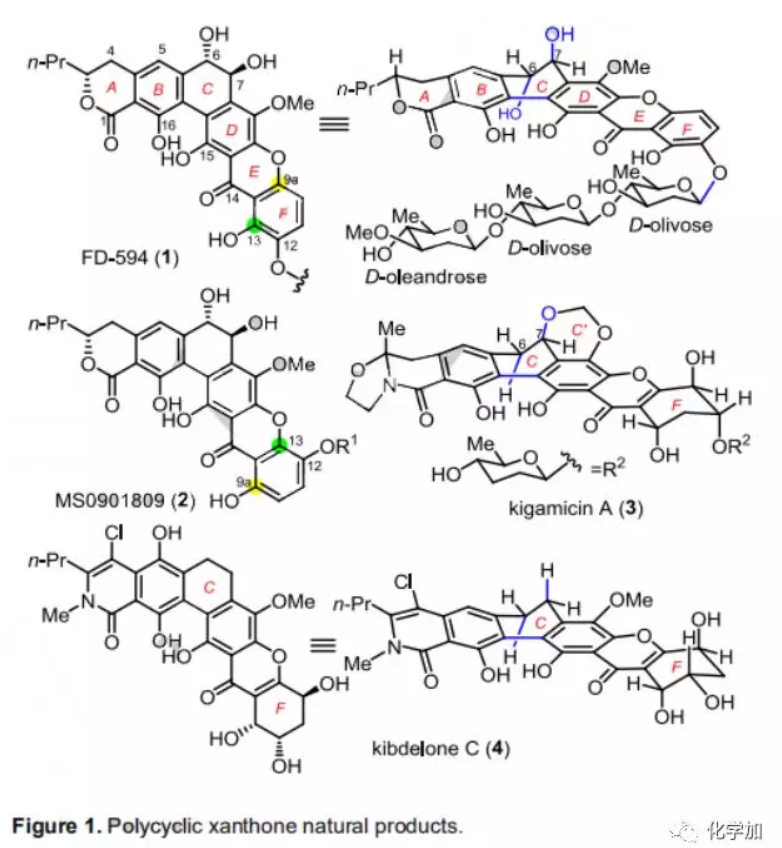
FD-594(1,Figure 1)是由Kakinuma課題組于1998年從鏈霉菌TA-0256中分離得到的一種復雜多環氧雜蒽酮類天然產物,對P388(IC50=0.25 μg/mL)和HeLa腫瘤細胞(IC50=0.10 μg/mL)具有抑制活性,并對某些革蘭氏陽性菌如金黃色葡萄球菌209P-J表現出中等活性(IC50=0.10 μg/mL)。FD-594的結構特征在于其高度氧化的六環骨架,包括苯酚并六元環內酯(A-B環)、反式9,10-二氫菲-9,10-二醇片段(B-C-D環)、氧雜蒽酮骨架(D-E-F環)和含D-齊墩果糖和D-橄欖糖的β-連接的三糖片段。FD-594與生源相關的多環蒽酮MS0901809(2)僅在E和F環的連接方式有所不同,而與其他多環氧雜蒽酮如kigamicin A(3)和kibdelone C(4)主要不同在于C和F環上的氧化態和官能團。多環氧雜蒽酮的獨特結構和生物活性引起了眾多化學家的關注,包括Kelly、Porco、Ready、Martin等人。2009年,Suzuki課題組開發了一種新策略即將手性從軸向轉移到中心從而構建出反式9,10-二氫菲-9,10-二醇的B-C-D環(Scheme 1A),并將該策略用于TAN-1085、PD-116740和Pradimicinone的全合成。最近,Bennett課題組通過試劑控制的策略利用對甲苯磺酰氯活化雙脫氧糖供體立體選擇性構建出β-連接的三糖片段。
(圖片來源:Angew. Chem. Int. Ed.)
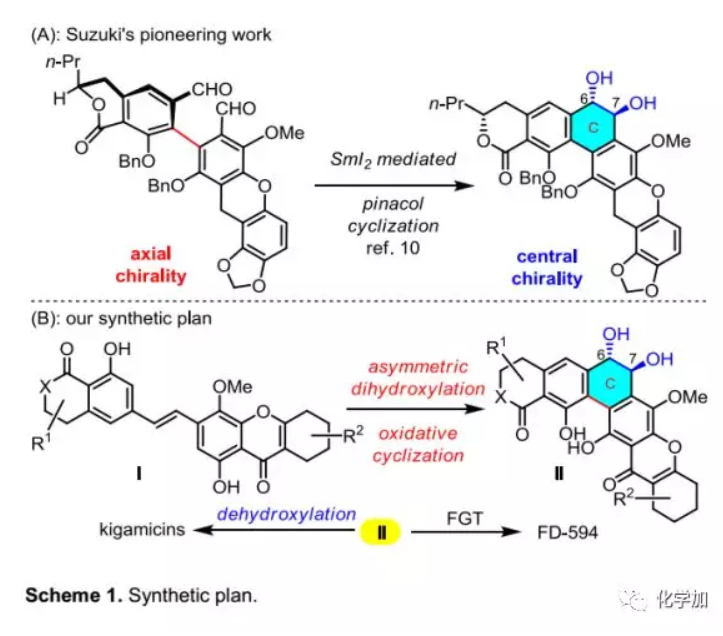
在先前工作中,華東師范大學高栓虎教授課題組利用光誘導的C-O鍵生成方法構建出四氫氧雜蒽酮,并合成了二聚氧雜蒽酮ascherxanthone A和多環氧雜蒽酮kibdelone C(4,6π電環化構建的BCD三環)(Org. Lett. 2017, 19, 1834-1837;Org. Lett. 2018, 20, 2872?2875)。近日,該課題組利用不對稱雙羥化/氧化環化的新策略構建了反式9,10-二氫菲-9,10-二醇母核(Scheme 1B,I→II),并首次完成了FD-594的不對稱全合成,該成果發表于Angew. Chem. Int. Ed.(DOI:10.1002/anie.201915787)。
(圖片來源:Angew. Chem. Int. Ed.)
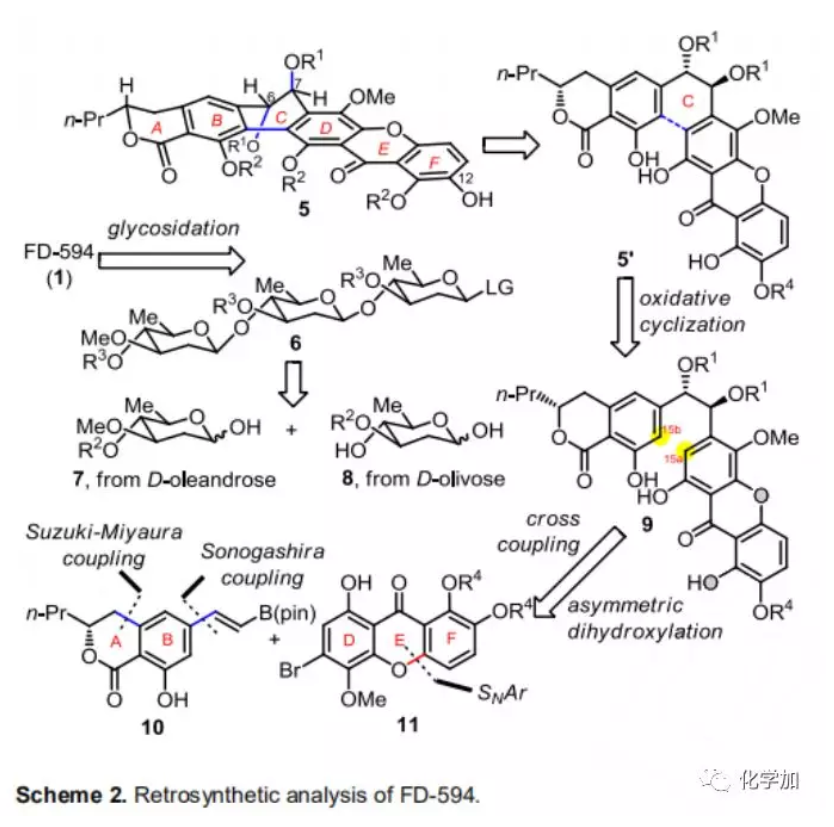
FD-594(1)的逆合成分析(Scheme 2):1可以由六環骨架5與三糖片段6通過后期糖基化偶聯產生,而6可以由2-脫氧糖7和8通過β-糖苷鍵連接形成。六環母核5可以由片段10(苯酚并六元環內酯結構A-B環)和11(氧雜蒽酮D-E-F環)通過Suzuki-Miyaura偶聯形成的產物進行不對稱雙羥化合成得到,最后經氧化環化構建出反式9,10-二氫菲-9,10-二醇結構(B-C-D環)。
(圖片來源:Angew. Chem. Int. Ed.)
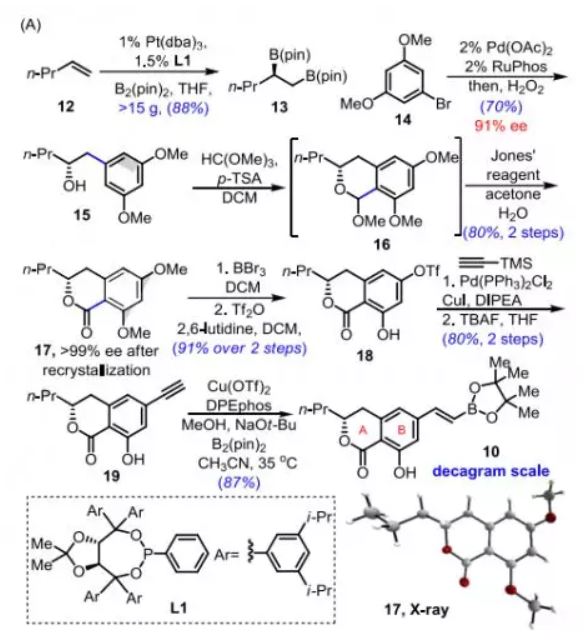
片段10的合成(Scheme 3A):作者以正戊烯12為原料,按照Morken報道的方法通過Pt-催化的不對稱雙硼化和Pd-催化的交叉偶聯得到醇15(91% ee,直接用于下一步),然后在酸介導下與原甲酸三甲酯環化,再經Jones氧化構建出苯酚并六元環內酯17,其結構和絕對構型通過單晶X-射線衍射確證,通過重結晶使其ee值提高至>99%。將17脫除甲基并選擇性活化酚羥基得到三氟甲磺酸酯18(兩步,91%),與乙炔基TMS進行 Pd-催化的Sonogashira偶聯,然后脫除TMS得到末端炔烴19(兩步,80%)。最后,在DPEphos存在下,進行Cu-催化的區域選擇性乙烯基硼酸化得到苯酚并六元環內酯結構即A-B環10(十克級規模,87%)。
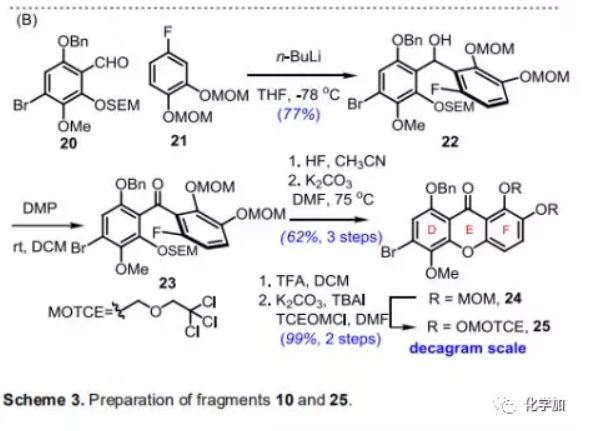
片段25的合成(Scheme 3B):將高度取代的苯環21進行位點選擇性鋰化后,與20分子間加成,再經Dess-Martin氧化得到二芳族酮23;用HF脫除其SEM保護基后,在堿性條件下進行SNAr反應構建C-O鍵得到含氧雜蒽酮骨架的中間體24(三步,62%)。最后,在F環上用MOTCE保護基代替MOM得到氧雜蒽酮(D-E-F環)片段25,兩步產率99%。(記得關注標題下方公眾號:化學加)
(圖片來源:Angew. Chem. Int. Ed.)
FD-594含有獨特的三糖片段,包括β-連接的2,6-二脫氧糖D-齊墩果糖和D-橄欖糖。由于C-2原子缺少可參與β-糖苷鍵形成的基團,將2,6-二脫氧糖進行立體選擇性糖基化充滿挑戰。作者利用Bennett課題組開發的策略,在2,4,6-三叔丁基嘧啶(TTBP)存在下,用對甲苯磺酰氯活化二脫氧糖供體得到的活性α-糖基甲苯磺酸酯,與受體通過SN2反應以優異的β-選擇性制備出克級規模的β-連接的三糖片段。
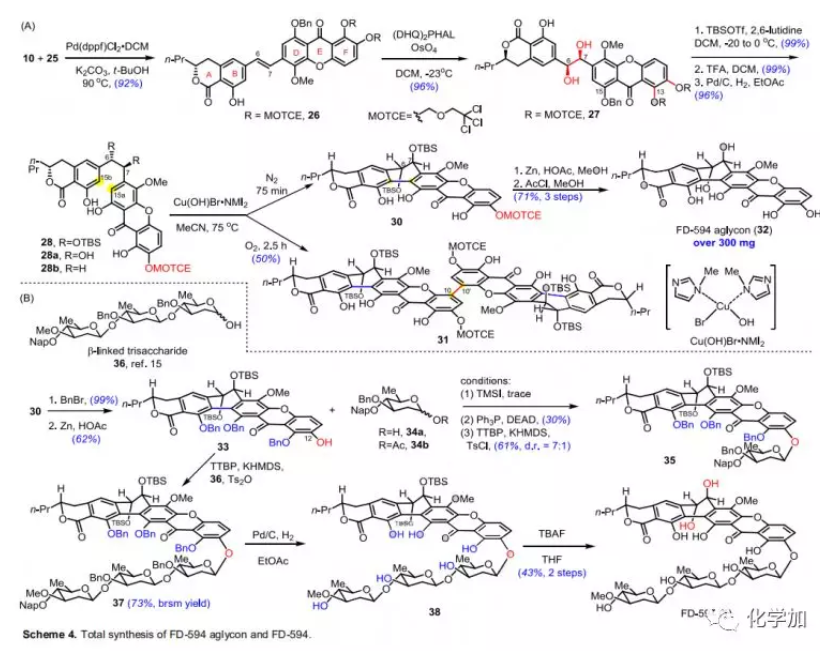
在得到所有片段后,作者嘗試構建六環母核骨架(Scheme 4A)。片段10和25經Pd-催化的Suzuki-Miyaura交叉偶聯以92%的收率得到26,其C6-C7雙鍵經不對稱雙羥化得到手性二醇27(96%),為單一非對映異構體。通過酸性條件和氫化選擇性脫除C-13、C-16和C-15位的保護基得到酚28(兩步,95%)。銅介導的氧化苯酚偶聯已廣泛用于構建芳基-芳基鍵,并在Tatsuta等人合成TMC 66以及Ready合成kigamicins中得到了驗證。為了研究氧化環化的反應性,作者還制備了在C-6和C-7位含游離羥基和飽和亞甲基的28a和28b。通過對反應條件的考察,作者發現在氮氣保護下,將化合物28與Cu(OH)Br?NMI2在75 ℃乙腈中反應75 min可以90%的粗品收率得到六環母核30;當用DMF作為溶劑時,轉化率低,即使延長反應時間,Cu(OH)Br?NMI2也無法反應完全。在相同的反應條件下,底物28a分解;而底物28b進行氧化環化的速率也相對較低,表明兩個大位阻TBS保護基使C-15a和C-15b更接近,從而促進后續氧化偶聯。當在氧氣氣氛下進行氧化苯酚偶聯時,發現環化產物30能夠發生分子間偶聯形成10,10'-二聚體31,將反應時間延長至2.5 h之后轉化完全,收率可達50%。通過Zn/AcOH和酸性條件脫除30的全部保護基得到FD-594糖苷配基32,其光譜數據與Suzuki報道的數據完全一致。自此,作者從14出發通過匯聚式方法以17個步驟20%的總收率合成了超過300 mg的FD-594糖苷配基。
接下來,作者將注意力轉向六環骨架和三糖片段的組裝(Scheme 4B)。首先,作者將三個游離酚羥基用芐醚保護,并用Zn/HOAc選擇性脫除C-12位的MOTCE保護基得到糖基受體33。隨后,作者選擇34a和34b作為模型底物考察了在三種常規反應條件下糖苷化的反應性和立體選擇性。用TMSI處理34b得到的糖基碘化物,使其與33反應,但僅產生痕量的糖苷產物并回收起始原料。在PPh3和DEAD存在下,用34a與33進行Mitsunobu糖基化可以30%的收率得到糖苷產物35,表明糖基供體和受體的反應性較差。然后,作者嘗試按照Bennett課題組報道的方法用對甲苯磺酰氯活化糖供體,將化合物34a轉化為相應的α-糖基對甲苯磺酸酯后,與經過KHMDS處理的受體33反應得到β-連接的糖苷35(61%,dr=7:1)為主要產物;通過相同的反應條件將三糖36與33偶聯,以55%的產率和β:α=2.2:1的立體選擇性得到β-連接的糖苷37。為了提高立體選擇性,作者通過改變磺酰化劑、添加劑和堿優化了糖基化的反應條件,發現使用三氟甲磺酸酐作為活化劑可以48%的收率(73%回收收率),單一選擇性地得到β-連接的糖苷37。作者認為,在該條件下,36的半縮醛立體定向轉化為α-糖基甲苯磺酸酯即糖基化中的反應性物質,這與Bennett觀察到的結果相符。隨后,用Pd/C-H2脫除37的芐基和萘甲基得到38。最后,利用TBAF脫除兩個TBS保護基,最終以兩步43%的收率得到FD-594(1),其1H和13C NMR、HR-MS和旋光數據與天然產物數據一致。
(圖片來源:Angew. Chem. Int. Ed.)
總結:華東師大高栓虎課題組利用匯聚式合成路線通過20步完成了復雜多環氧雜蒽酮FD-594的首次不對稱全合成。作者通過Pt-催化的不對稱雙硼化以及Pd-催化的交叉偶聯構建出手性苯酚并六元環內酯結構(A-B環);通過不對稱雙羥化和Cu-介導的氧化環化的新合成策略構建出反式9,10-二氫菲-9,10-二醇結構(B-C-D環);通過后期立體選擇性糖基化構建出含2,6-二脫氧三糖片段的六環骨架。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn