



自然界衍化出了以蛋白框架為代表的模板結(jié)構(gòu),用于引導(dǎo)生物礦化過程,生成各種復(fù)雜、精巧的生物硬組織。盡管過去十年,生物礦化及仿生礦化領(lǐng)域有長足的進(jìn)展,如仿生貝殼結(jié)構(gòu)的構(gòu)建,但是設(shè)計程序可控的仿生礦化方法仍面臨諸多困難,比如磷酸鈣(Calcium Phosphate, CaP)的礦化過程就受到無法精準(zhǔn)控制形貌和缺乏普適性方案的限制。
近日,上海交通大學(xué)化學(xué)化工學(xué)院樊春海團(tuán)隊提出了一種解決思路:即利用框架核酸作為模版,以靜電相互作用為驅(qū)動力,制備具有規(guī)定形貌的礦化CaP納米晶體。該工作以“DNA Framework-Encoded Mineralization of Calcium Phosphate“為題,于2020年1月2日在線發(fā)表在Cell期刊旗下的Chem雜志中。劉小果、靖薪薪為論文的共同第一作者,樊春海為通訊作者。
在眾多生物礦物中,作為人體骨骼和牙齒主要無機(jī)組分的磷酸鈣(CaP),其合成與結(jié)構(gòu)設(shè)計倍受研究者親睞。但由于存在非經(jīng)典成核過程及復(fù)雜的相組成與變化,使得合成精細(xì)的CaP納米結(jié)構(gòu)困難重重。團(tuán)隊利用框架核酸為模版來誘導(dǎo)CaP納米晶體的礦化過程,成功地按照預(yù)設(shè)形貌制備出相應(yīng)的幾何結(jié)構(gòu),并因為CaP外殼的保護(hù)作用,使得DNA的環(huán)境耐受性得以增強(qiáng),進(jìn)一步拓寬了DNA納米結(jié)構(gòu)的應(yīng)用領(lǐng)域。
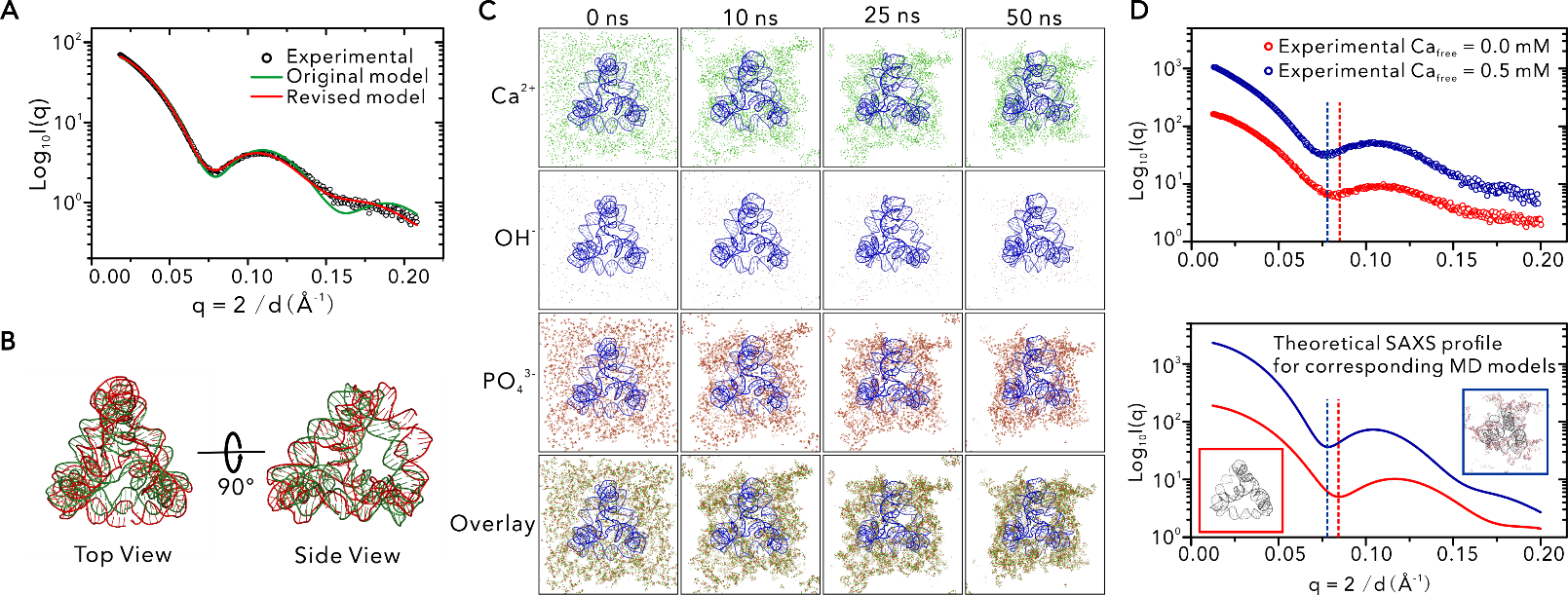
分子動力學(xué)模擬及同步輻射小角X射線散射數(shù)據(jù)揭示DNA四面體誘導(dǎo)CaP生長的早期過程
論文指出DNA磷酸骨架與Ca離子之間的親和性以及可編碼的DNA結(jié)構(gòu)是控制CaP礦化以獲得規(guī)定幾何結(jié)構(gòu)的關(guān)鍵,并且CaP外殼不僅可以保留框架核酸的結(jié)構(gòu)信息,也能夠作為保護(hù)層增加功能性核苷酸在細(xì)胞內(nèi)的轉(zhuǎn)運效率。團(tuán)隊認(rèn)為,只要化學(xué)反應(yīng)條件滿足框架核酸的耐受范圍,這種策略就有希望應(yīng)用于諸如碳酸鈣和金屬氧化物等具有光學(xué)、電學(xué)和磁特性的眾多無機(jī)材料的結(jié)晶控制中。
原文鏈接:https://www.sciencedirect.com/science/article/abs/pii/S2451929419305509
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn