




干細胞是一類具有自我復制能力的多潛能細胞,其中,骨髓間充質(zhì)干細胞具有獨特的生物學功能,如歸巢到受損組織部位、分化為多種類型細胞、分泌多種生物活性分子和發(fā)揮免疫調(diào)節(jié)功能等,對生物醫(yī)學研究和細胞治療等具有重大價值。骨髓中的間充質(zhì)干細胞含量極低,僅占單核細胞總數(shù)的0.001%~0.01%,因此,從數(shù)以萬計的骨髓細胞中捕獲干細胞且保持干細胞的活性極具挑戰(zhàn)性。
脫氧核糖核酸(DNA)作為生命遺傳分子,是可編程的生物大分子,近年來開始用于制造新型生物材料,尤其是DNA水凝膠材料蓬勃發(fā)展(Progress in Polymer Science, 2019, 101163)。近期,天津大學化工學院仰大勇教授課題組開發(fā)了一種基于物理交聯(lián)的DNA水凝膠網(wǎng)絡的細胞捕獲策略,實現(xiàn)了對骨髓間充質(zhì)干細胞的高效捕獲、三維包封和酶促釋放。這種細胞捕獲策略是通過兩種超長DNA鏈協(xié)同作用實現(xiàn):DNA鏈-1包含能高效靶向干細胞的適配體序列,特異性錨定干細胞;DNA鏈-2包含與DNA鏈-1部分互補的序列,通過與DNA鏈-1雜交形成三維網(wǎng)絡,實現(xiàn)干細胞的三維包封;在核酸酶作用下,DNA網(wǎng)絡被降解,干細胞可控釋放。這種物理交聯(lián)的DNA水凝膠網(wǎng)絡不僅為細胞培養(yǎng)提供了彈性、半濕潤和三維的類細胞外基質(zhì)環(huán)境,而且其適當?shù)目讖接欣跔I養(yǎng)物質(zhì)的運輸以及細胞代謝廢物的排出,可以確保被包封的細胞保持良好的活性。在該研究基礎上,利用DNA分子的可編程性和分子識別能力,可以設計具有不同結構和功能的DNA網(wǎng)絡,為捕獲和培養(yǎng)其他類型的細胞提供了一種通用策略。
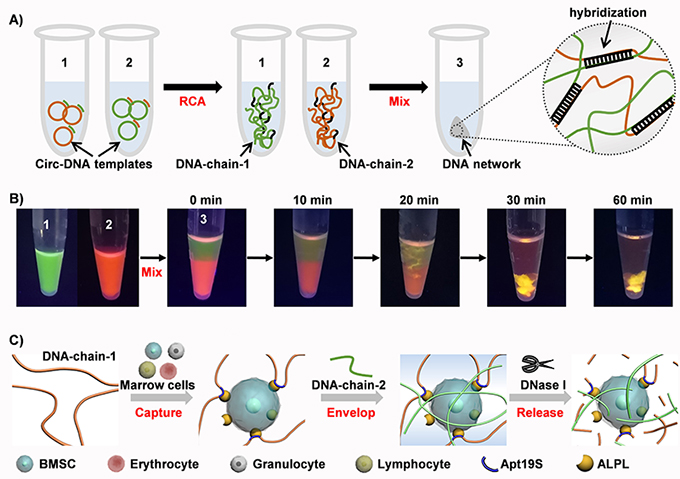
圖. 用于捕獲干細胞的DNA水凝膠網(wǎng)絡的設計
A)通過滾環(huán)擴增方法(RCA)合成超長DNA鏈,以及通過DNA鏈之間堿基互補配對形成三維DNA網(wǎng)絡的示意圖。
B)DNA網(wǎng)絡形成過程中的分子擴散和相轉化。DNA鏈-1和DNA鏈-2分別用SYBR Green II和Gel Red染色。
C)高效捕獲、三維包封和酶促釋放的示意圖:1)捕獲:將DNA鏈-1與骨髓間充質(zhì)干細胞(BMSC)孵育,適體Apt19S錨定BMSC;2)包封:引入DNA鏈-2以觸發(fā)DNA網(wǎng)絡的形成,三維包封BMSC;3)釋放:DNA網(wǎng)絡可被核酸酶DNase I降解,釋放BMSC。
論文信息:Chi Yao+, Han Tang+, Weijian Wu, Jianpu Tang, Weiwei Guo, Dan Luo, Dayong Yang*, Double Rolling Circle Amplification Generates Physically Crosslinked DNA Network for Stem Cell Fishing. Journal of the American Chemical Society, 2020.
原文鏈接:https://pubs.acs.org/doi/10.1021/jacs.9b11001
仰大勇教授簡介

仰大勇 博士,天津大學化工學院教授、院長助理,入選國家級海外人才計劃、國家優(yōu)青、天津市杰青。現(xiàn)任天津大學校學術委員會委員、中國生物醫(yī)學工程學會納米醫(yī)學與工程分會委員。課題組研究方向是材料化學與生物醫(yī)學的交叉領域,聚焦DNA合成與智能制造,利用材料化學的手段理解生命系統(tǒng)運行機制,探索重大疾病的診斷治療新途徑。
課題組主頁:http://yanglab-dna.com/
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn