



近年來(lái),一類(lèi)以動(dòng)力學(xué)過(guò)程為主導(dǎo)的基因表達(dá)調(diào)控元件引起人們的關(guān)注。此類(lèi)元件對(duì)下游報(bào)告基因的表達(dá)調(diào)控主要由動(dòng)力學(xué)過(guò)程實(shí)現(xiàn),其對(duì)目標(biāo)配體的響應(yīng)過(guò)程通常在幾秒內(nèi)發(fā)生。響應(yīng)過(guò)程中沒(méi)有明顯的穩(wěn)定平衡狀態(tài),調(diào)控元件的轉(zhuǎn)錄和翻譯過(guò)程持續(xù)發(fā)生,過(guò)程中各生物大分子(RNA聚合酶、核糖體、轉(zhuǎn)錄終止因子等)之間的動(dòng)態(tài)配合決定了下游被調(diào)控基因的表達(dá)水平。一些代表性的調(diào)控元件包括核糖開(kāi)關(guān)、原核生物中的前導(dǎo)肽以及真核生物中的上游開(kāi)放讀碼框(uORF,upstream Open Reading Frame)。在天然狀態(tài)下,這些調(diào)控元件主要參與到生物體內(nèi)多種重要的信號(hào)通路,如細(xì)菌的環(huán)境壓力響應(yīng)、植物的養(yǎng)分感知、人類(lèi)疾病相關(guān)基因的調(diào)控。對(duì)此類(lèi)元件作用機(jī)制的深入探究一方面能夠提升對(duì)相關(guān)信號(hào)通路調(diào)控網(wǎng)絡(luò)的認(rèn)知水平,為微生物耐藥性、作物培育、人類(lèi)基因相關(guān)疾病的研究提供理論指導(dǎo);另一方面,在明確其調(diào)控原理的基礎(chǔ)上,有可能將其改造為代謝物生物傳感器。由于這類(lèi)調(diào)控元件以動(dòng)力學(xué)過(guò)程為主導(dǎo)的特點(diǎn),相比于傳統(tǒng)蛋白質(zhì)調(diào)控類(lèi)的傳感器,此類(lèi)傳感器在響應(yīng)配體分子的響應(yīng)速度方面具有獨(dú)特優(yōu)勢(shì)。
然而由于這些調(diào)控元件發(fā)揮功能時(shí)的動(dòng)力學(xué)過(guò)程變化迅速,導(dǎo)致對(duì)于其動(dòng)力學(xué)機(jī)制的理解十分困難。基于零散突變分析,結(jié)構(gòu)解析和體外生化等傳統(tǒng)手段, 只能對(duì)動(dòng)力學(xué)過(guò)程中一些較為穩(wěn)定的中間狀態(tài)進(jìn)行研究,無(wú)法提供元件整體及其連續(xù)動(dòng)態(tài)的作用機(jī)理。對(duì)于此類(lèi)動(dòng)力學(xué)過(guò)程主導(dǎo)的響應(yīng)元件,如果能夠通過(guò)高通量的表征手段獲取其響應(yīng)過(guò)程的分子機(jī)制(如元件所有位點(diǎn)所有突變類(lèi)型對(duì)其響應(yīng)性能的影響),結(jié)合已有的靜態(tài)研究結(jié)果,就可以建立該元件響應(yīng)過(guò)程的動(dòng)力學(xué)模型,進(jìn)而從動(dòng)態(tài)的角度來(lái)對(duì)調(diào)控元件進(jìn)行機(jī)理分析,在進(jìn)一步理解其機(jī)制的基礎(chǔ)上,為代謝物生物傳感器的改造提供方法基礎(chǔ)。
論文選取這類(lèi)調(diào)控元件中重要的TnaC前導(dǎo)肽為研究體系。TnaC前導(dǎo)肽是核糖體阻滯肽(ribosome-arrest peptide)的一種,通過(guò)協(xié)調(diào)RNA聚合酶、核糖體和Rho轉(zhuǎn)錄終止因子三種大分子機(jī)器在轉(zhuǎn)錄翻譯tnaC過(guò)程中的動(dòng)力學(xué)行為,可以對(duì)一定濃度范圍的胞內(nèi)色氨酸產(chǎn)生響應(yīng),調(diào)節(jié)重要的種間信號(hào)分子吲哚的合成。論文首先建立了基于流式分選-測(cè)序(FACS-seq)高通量分析的完整實(shí)驗(yàn)操作流程和數(shù)據(jù)分析框架,在該框架下對(duì)包含1450個(gè)成員的tnaC突變文庫(kù)在多個(gè)色氨酸濃度下的響應(yīng)特性進(jìn)行了測(cè)量。根據(jù)FACS-seq分析結(jié)果繪制出了tnaC傳感器的“序列-性能”圖譜,該圖譜的深度分析結(jié)果,除了能夠驗(yàn)證已報(bào)道的tnaC功能外,還發(fā)現(xiàn)了其響應(yīng)過(guò)程中諸多未知的重要中間狀態(tài),并結(jié)合文獻(xiàn)調(diào)研與實(shí)驗(yàn)驗(yàn)證提出了這些新發(fā)現(xiàn)背后可能存在的動(dòng)力學(xué)機(jī)制。
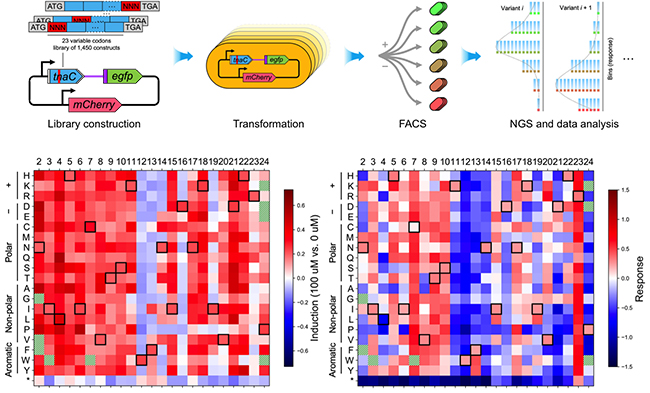
圖1. 本論文建立的FACS-seq高通量分析流程及TnaC深度突變掃描圖譜
在此基礎(chǔ)上,為了回答FACS-seq分析是否完整捕獲了全部重要的響應(yīng)中間狀態(tài),以及這些動(dòng)力學(xué)中間態(tài)如何相互協(xié)調(diào)影響tnaC響應(yīng)性能這一基本科學(xué)問(wèn)題,論文以新發(fā)現(xiàn)的tnaC響應(yīng)過(guò)程關(guān)鍵節(jié)點(diǎn)為基礎(chǔ),建立了描述其協(xié)調(diào)RNA聚合酶、核糖體和Rho轉(zhuǎn)錄終止因子三種大分子機(jī)器動(dòng)力學(xué)行為的隨機(jī)過(guò)程模型,該模型能夠準(zhǔn)確預(yù)測(cè)不同突變體的響應(yīng)性能,對(duì)于tnaC基礎(chǔ)響應(yīng)和誘導(dǎo)相應(yīng)之間的平衡關(guān)系給出了定量的機(jī)制性理解。最后該模型為改造tnaC傳感器的性能指標(biāo)提供了指導(dǎo)方案,據(jù)此獲得了檢測(cè)范圍有明顯擴(kuò)展的tnaC傳感器突變體。
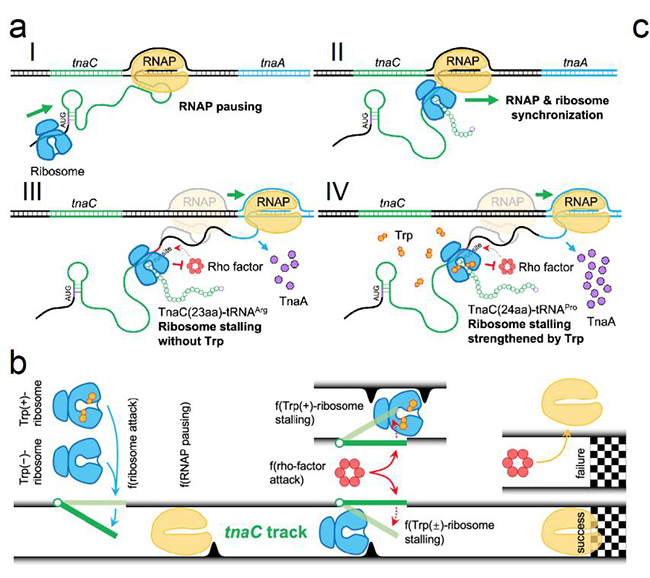
圖2. TnaC動(dòng)態(tài)響應(yīng)機(jī)制及其動(dòng)力學(xué)隨機(jī)過(guò)程模型
此外,根據(jù)上述分析,本論文還提出了tnaC功能模塊化的觀點(diǎn):以其中的色氨酸殘基為分水嶺,僅僅75個(gè)核苷酸組成的tnaC基因的上下游兩部分分別在mRNA和肽水平上獨(dú)立控制其動(dòng)力學(xué)過(guò)程的幾個(gè)關(guān)鍵參數(shù)。系統(tǒng)發(fā)育分析揭示了模型預(yù)測(cè)的tnaC基因功能模塊化現(xiàn)象在腸道細(xì)菌中的普遍存在性。由于吲哚生物合成的調(diào)控在這些腸道細(xì)菌演化歷程中受到了嚴(yán)格的選擇壓力,這進(jìn)一步反映了吲哚信號(hào)分子在腸道菌群中的重要潛在功能。tnaC關(guān)系到重要信號(hào)分子吲哚的合成與運(yùn)輸,該發(fā)現(xiàn)對(duì)研究吲哚信號(hào)通路和壓力因子耐受性具有重要意義。
化工系張翀副教授和王天民博士(現(xiàn)為清華大學(xué)醫(yī)學(xué)院博士后)為本文通訊作者,生物育種技術(shù)與裝備團(tuán)隊(duì)首席邢新會(huì)教授為本文共同作者,他們均為清華大學(xué)合成與系統(tǒng)生物學(xué)研究中心核心成員。王天民博士和清華大學(xué)化工系已畢業(yè)博士研究生鄭翔為本文的共同第一作者。該成果得到了國(guó)家自然科學(xué)基金委重點(diǎn)儀器研發(fā)項(xiàng)目、面上項(xiàng)目的資助。
論文鏈接:
https://www.nature.com/articles/s41589-019-0430-3
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來(lái)源標(biāo)注錯(cuò)誤或侵犯了您的合法權(quán)益,請(qǐng)作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時(shí)更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn