

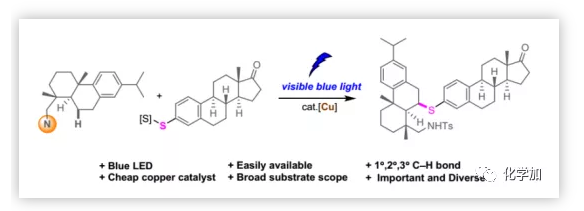
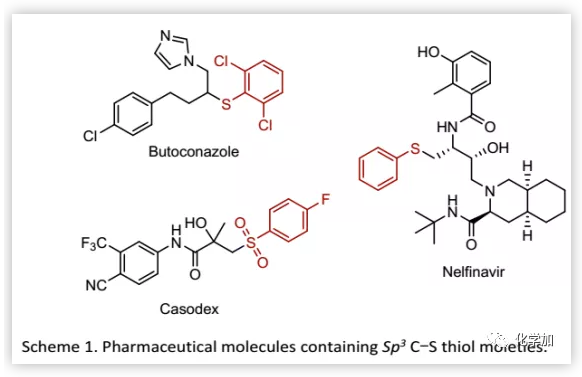
Sp3 C-S鍵在現代有機合成、天然產物和藥物中發揮著重要作用。例如,抗真菌藥Butoconazole和抗逆轉錄病毒藥物Nelfinavir(Scheme 1)。臨床實驗表明, Sp3 C-S鍵的引入可以改善藥物分子的生物學活性。除此之外,Sp3 C-S鍵還存在于半胱氨酸等天然氨基酸中。考慮到含Sp3 C-S鍵化合物的重要性,迫切需要開發能夠通過C-H鍵的直接官能團化高效選擇性地構建Sp3 C-S鍵的方法。此外,這些方法還可以促進復雜分子的后期官能團化,有利于分子多樣化和化合物庫構建。
(圖片來源:Chem. Sci.)
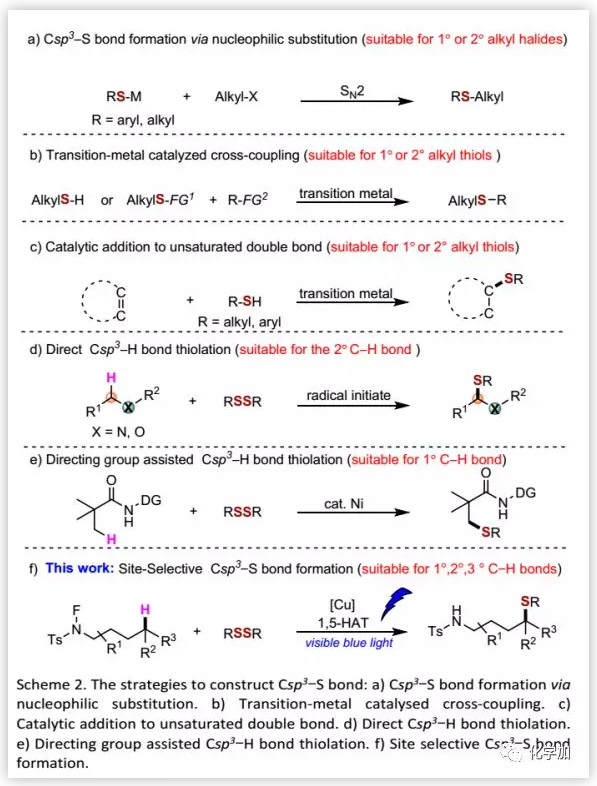
傳統的構建Sp3 C-S鍵的方法是通過金屬硫醇鹽與烷基鹵化物間的親核取代來實現的(Scheme 2a),但其對空間位阻敏感。隨著過渡金屬催化劑的發展,過渡金屬催化的有機鹵化物/烯烴和硫醇/硫醚的交叉偶聯可以更有效地引入Sp3 C-S鍵(Scheme 2b)。同時,烯烴的氫硫醇化提供了一種構建Csp3-S鍵的方法,但該方法需要將底物預官能團化,并且其區域選擇性主要取決于底物的結構(Scheme 2c)。此外,雜原子鄰位Sp3 C-H 鍵(Scheme 2d)以及導向基輔助(Scheme 2e)的Sp3 C-H 鍵的直接硫醇化反應提供了一種構建Csp3-S鍵的方法。Sp3 C-H鍵的直接硫醇化仍然充滿著挑戰。
受Hofmann-L?ffler-Freytag(HLF)反應的啟發,通過自由基途徑的C-H官能團化為構建目標分子提供了新途徑。盡管基于該路徑來實現碳氫鍵官能團的反應已經取得了豐碩的成果,但對于碳硫鍵及碳硒鍵的轉化尚未報道。基于碳硫鍵在藥物分子及天然產物中的重要性,陜西師范大學楊明瑜課題組在前期1,5-HAT的分子內胺化反應(Chem.Commun., 2017, 53, 5744)及分子間氧化反應(Chem. Sci., 2018, 9, 6374)研究的基礎上,開發了一種通過光驅動/銅催化的1,5-HAT策略的脂肪胺類化合物的選擇性硫醇化(Scheme 2f),該成果發表于近期Chem. Sci.(DOI: 10.1039/C9SC04169A)。
(圖片來源:Chem. Sci.)
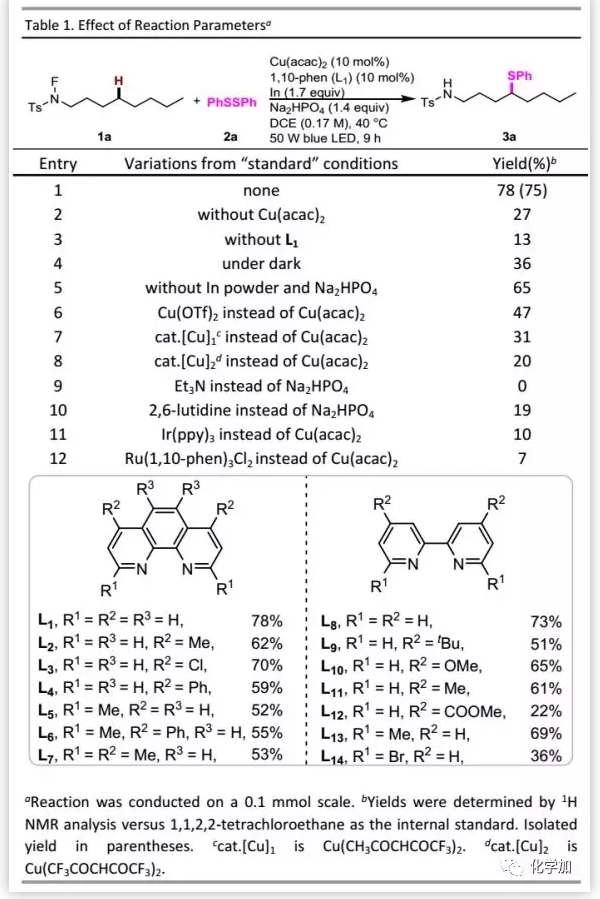
首先,作者以N-氟甲苯磺酰胺1a和二苯二硫醚2a作為模型底物進行研究(Table 1)。經過條件優化后,發現在藍色LED存在下,以10 mol% Cu(acac)2、10 mol% 1,10-phenanthroline(L1)、1.4 eq. Na2HPO4和1.7 eq.銦粉的混合物作為添加劑時可以75%的分離收率得到預期的δ-硫醇化產物3a。對照實驗表明:在沒有銅催化劑或配體存在下,收率顯著下降;在無光照情況下僅以36%的收率得到預期產物,表明光在該轉化中起關鍵作用;在沒有銦粉和堿存在下,收率較低。此外,利用其他銅絡合物,均導致收率降低。在光氧化還原反應中,脂肪胺通常是良好的還原劑,但加入三乙胺會抑制該反應。為了確定銅絡合物在該轉化中的作用,作者分別用Ir和Ru代替Cu,但結果均不理想,表明銅在該反應中不僅是光氧化還原催化劑,還有其他作用。
(圖片來源:Chem. Sci.)
確定最佳反應條件后,作者考察了二硫化物的適用范圍(Table 2)。含有給電子基團如甲基、甲氧基和乙酰氧基的二硫化物均具有良好的耐受性;含有鹵素甚至多鹵或氟取代的芳基二硫化物也可以參與硫醇化反應;然而,含硝基的二硫化物導致反應性降低。苯硫基在光電材料中通常具有特殊的性質,能以可接受的收率得到預期產物。此外,二硫化芐可以較低的收率(45%)得到δ-芐硫醚。當用二硒化物代替二硫化物時,也可以實現δ-硒化。
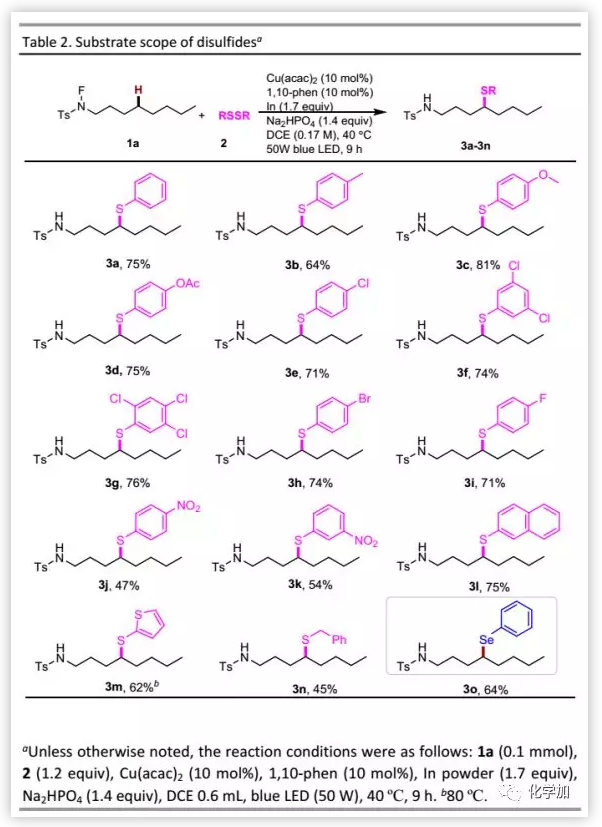
(圖片來源:Chem. Sci.)
作者開發的C-H硫醇化方法也可以用于各種電性和空間因素的伯、仲和叔脂肪族C-H鍵的官能團化(Table 3)。對于α-位含有取代基的N-氟甲苯磺酰胺底物,伯C-H鍵的硫醇化收率略有提高。此外,N-氟甲酰胺也是該轉化的良好底物。仲C-H鍵的官能團化可以選擇性得到一系列硫醚衍生物。即使底物中含有較長碳鏈,該反應也僅發生在δ-位。然而,在線性N-氟酰胺底物β-位的gem-二烷基未能提高收率。與生物學相關的官能團如Nphth、羧酸酯和OTBDMS以及OBz等均具有良好的耐受性。對于在反應中心附近含雜原子的4h和4j,只觀察到δ-選擇性。四元-七元的環烷烴可以良好的收率進行硫醇化。相比于叔丁基,金剛烷基可以在仲C-H鍵選擇性官能團化。在雜環中,六元環α-位官能化得到產物的非對映選擇性優于五元環。然而,N-氟酰胺的α-或β-位取代基的空間位阻導致較差的非對映選擇性。1,5-HAT和1,6-HAT過程均發生在底物ε-位的叔C-H鍵。最后,該轉化還可以用于構建含巰基的季碳中心,從而突出其合成實用價值。
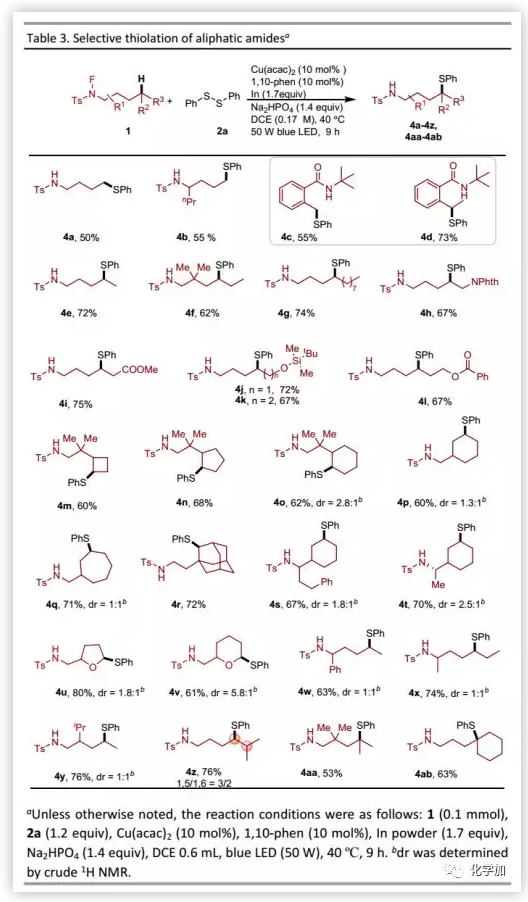
(圖片來源:Chem. Sci.)
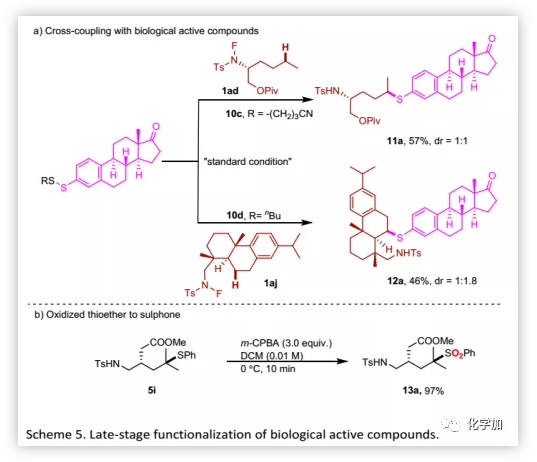
接下來,作者將該方法用于生物活性分子的后期官能團化(Table 4)。氨基醇衍生物可以與多種二硫化物偶聯,其產物一般是活性化合物的重要中間體,證明了該方法的廣泛實用性。甲基的不對稱硫醇化發生在薄荷醇衍生的N-氟酰胺底物上。此外,藥物分子和復雜天然產物均可以優異的區域選擇性進行結構修飾。
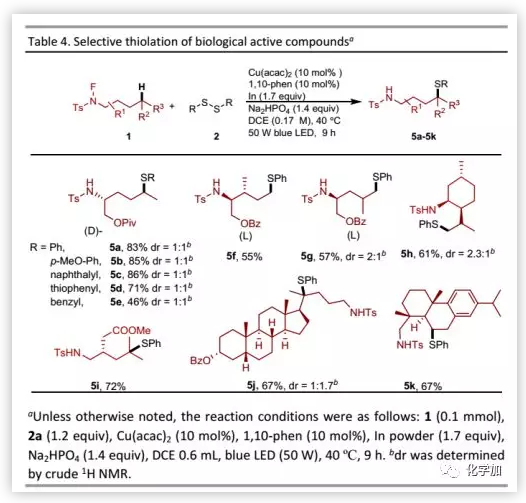
(圖片來源:Chem. Sci.)
隨后,為了說明該反應對構建藥物骨架的實用性,作者考察了一種可以通過1,5-HAT、環化和硫醇化組成的串聯反應合成巰基取代的吡咯烷或哌啶衍生物的底物(Scheme 3)。
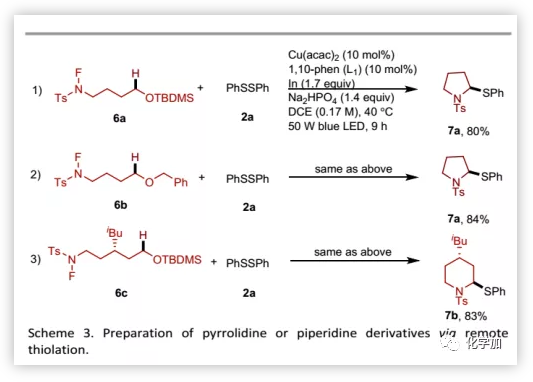
(圖片來源:Chem. Sci.)
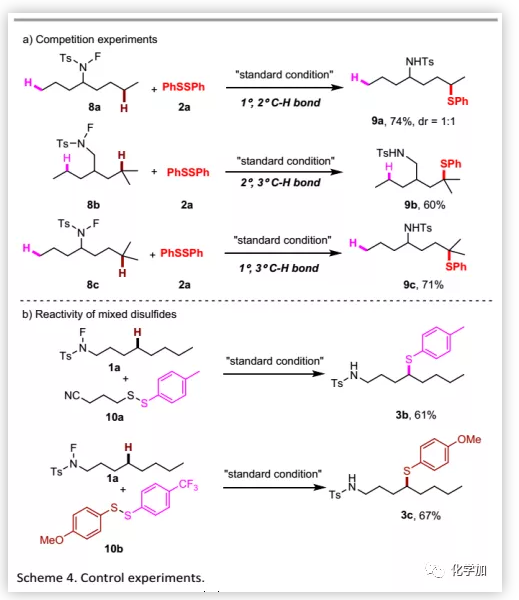
為了深入了解反應機理,作者分別進行了1°/2°C-H鍵、2°/3°C-H鍵和1°/ 3°C-H鍵之間的競爭性實驗(Scheme 4a),發現氫原子的反應性順序為叔>仲>伯。此外,為了測試硫醇化試劑的選擇性,作者用混合的二硫化物進行該轉化(Scheme 4b):對于烷基苯基二硫化物,只得到苯硫醚產物;對于既含給電子基OMe又含吸電子基CF3的芳基二硫化物,硫醇化只發生在含給電子基OMe取代的硫醇上,這可能是由不同硫上的電子云密度所導致。基于這種選擇性,作者開發了兩個生物活性分子之間的直接交叉偶聯得到相應的共軛化合物(Scheme 5a)。隨后,硫醚可以直接被氧化為廣泛存在于藥物中的砜(Scheme 5b)。
(圖片來源:Chem. Sci.)
(圖片來源:Chem. Sci.)
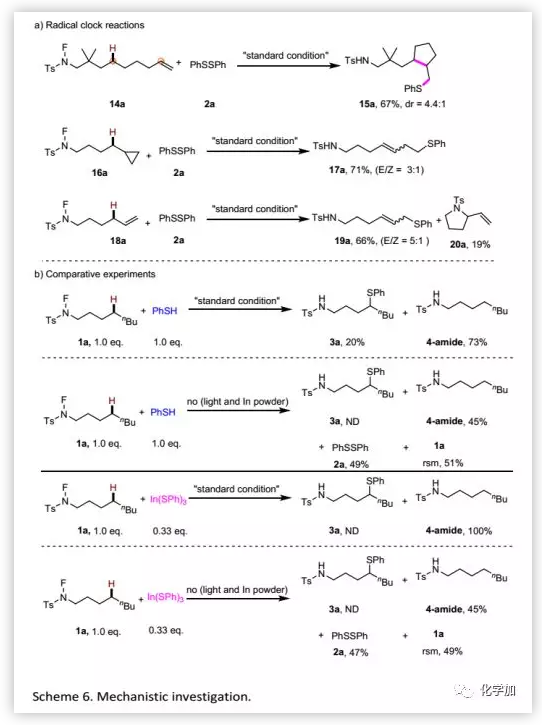
此外,作者還進行了自由基對照實驗以揭示存在自由基中間體的證據(Scheme 6a)。Radical-clock實驗觀察到產物15a、17a和19a表明在轉化過程中形成了碳自由基。特別是對于19a,觀察到的線性選擇性顯示該過程可能涉及η1-或η3-金屬烯丙基中間體。隨后,在TEMPO和BHT存在下進行的實驗結果進一步證明了自由基過程。此外,作者分別用PhSH和In(SPh)3進行實驗以考察硫醇化反應涉及的可能活性物質。結果表明,用PhSH作為硫醇化試劑時,以20%的收率得到預期產物;而用In(SPh)3作為硫醇化試劑時,未得到預期產物(Scheme 6b)。最后,通過空白實驗確認了各種添加劑在反應中的作用。
(圖片來源:Chem. Sci.)
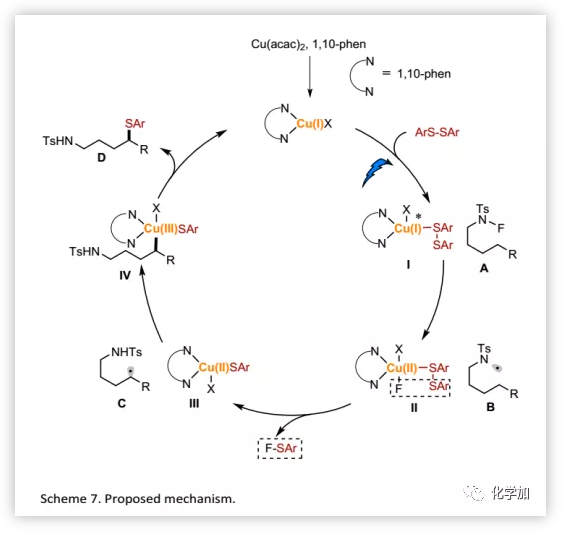
基于上述結果,作者認為該轉化傾向于光驅動/銅引發的1,5-HAT過程(Scheme 7)。首先,原位生成的Cu(I)催化劑與二硫化物發生配體交換生成Cu(I)-I,被可見光激發后,還原N-F酰胺A得到氮自由基B和Cu(II)-II中間體。Cu(II)-II通過復分解過程釋放一個分子F-SAr得到Cu(II)-III。生成的氮自由基B通過1,5-HAT移位形成碳自由基C,然后δ-C-自由基被Cu(II)-III捕獲形成Cu(III)-IV中間體。最后,還原消除,得到預期產物D并再生活性Cu(I)催化劑。
(圖片來源:Chem. Sci.)
總結:陜西師范大學楊明瑜副教授課題組開發了一種光驅動/銅催化的脂肪胺Csp3-H鍵的區域選擇性硫醇化反應,可以將伯、仲和叔C-H鍵成功轉化為C-S鍵。該方法具有廣泛的底物適用范圍、良好的官能團相容性以及生物活性中間體的后期修飾能力,突出了其獨特的合成潛力。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn