


(圖片來源:J. Am. Chem. Soc.)
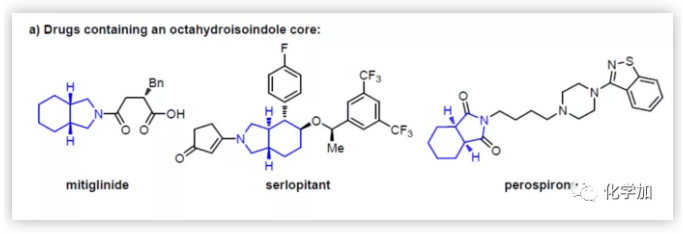
雜雙環八氫異吲哚骨架普遍存在于天然產物和藥物中,如治療Ⅱ型糖尿病口服降糖藥米格列奈(Mitiglinide),治療慢性瘙癢癥的Serlopitant和抗精神病藥物哌羅匹隆(Perospirone)(Figure 1a)。因此,一些高效、選擇性的方法已被開發用于制備此類骨架。該類方法包括1,6-烯與烯烴或炔的[2+2+2]環加成,含烯或炔基乙烯基環丙烷的環加成,兩者均由銠催化完成。但是,由于這些金屬催化環加成反應對空間和電子要求較高,導致無法獲得多種八氫異吲哚衍生物。
(圖片來源:J. Am. Chem. Soc.)
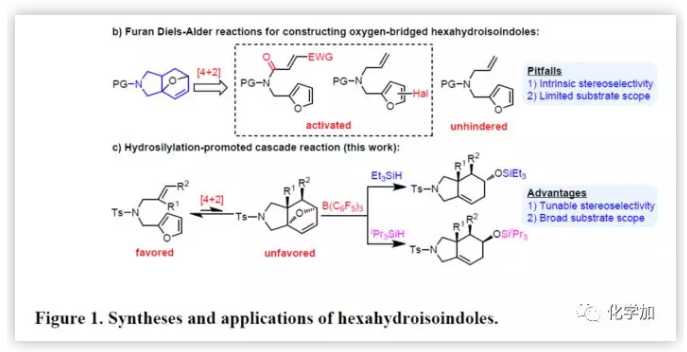
最近,作者通過N-烯丙基-N-糠酰胺作為底物,實現了分子內呋喃Diels-Alder反應,一步合成了氧橋聯的六氫異吲哚衍生物(Figure 1b),這些含有氧橋鍵和烯烴基的產物可進一步作為其它反應的底物。盡管這種方法早已為人所知,并且已經得到充分研究,但底物范圍仍然受到限制。活化基團(含鹵素的呋喃環或含吸電子基團的烯烴)通常是反應所必需的。未活化底物的環加成反應是可逆的,即使是無空間位阻的單取代末端烯烴底物也可以進行Diels-Alder逆反應,從而再生原料。另外,未活化的非末端烯烴通常是不反應的。更重要的是,未活化的底物(如羰基)與催化劑缺乏締合,使得外部控制立體選擇幾乎不可能。在此,南開大學王曉晨研究員課題組報道了,可將底物范圍擴大到包括多位阻親二烯體的呋喃Diels-Alder反應,涉及硼烷催化的氫化硅烷化串聯過程(Figure 1c)。出人意料的是,通過改變硅烷基可實現立體選擇性控制,對照實驗和計算研究表明,硅烷基的空間體積決定了反應機理途徑。
(圖片來源:J. Am. Chem. Soc.)
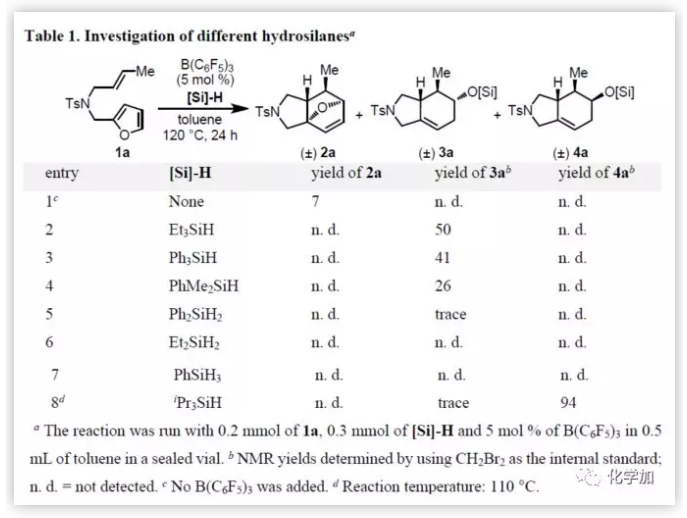
首先,作者以呋喃1a作為模型底物對反應條件進行了篩選(Table 1)。反應結果表明,在無催化劑時,當1a在甲苯中以120 ℃加熱12小時,僅獲得7%收率的Diels-Alder產物2a,剩余均為未轉化的底物(entry 1)。而在Et3SiH和B(C6F5)3催化條件下,環加成/醚斷裂串聯反應即可發生,得到產率為50%的六氫異吲哚3a(entry 2),剩余的則為原料分解產生的未知物。該結果證實,醚斷裂可將原本不利的[4+2]環加成反應向產物3a平衡。其它氫硅烷(Ph3SiH、PhMe2SiH、Ph2SiH2、Et2SiH2和PhSiH3)均未能提高3a的產率(entries 3-7)。然而,令作者驚訝的是,當測試iPr3SiH時(entry 8),反應獲得的產物不是3a而是4a(94%),4a作為3a的非對映異構體,通過NMR和單晶X-射線已確認結構的正確性。此外,所有立體中心都是在呋喃Diels-Alder反應中形成,其選擇性僅由底物的電子和空間效應控制,而此篩選結果表明,改變硅烷基也會影響立體選擇性的結果。
(圖片來源:J. Am. Chem. Soc.)
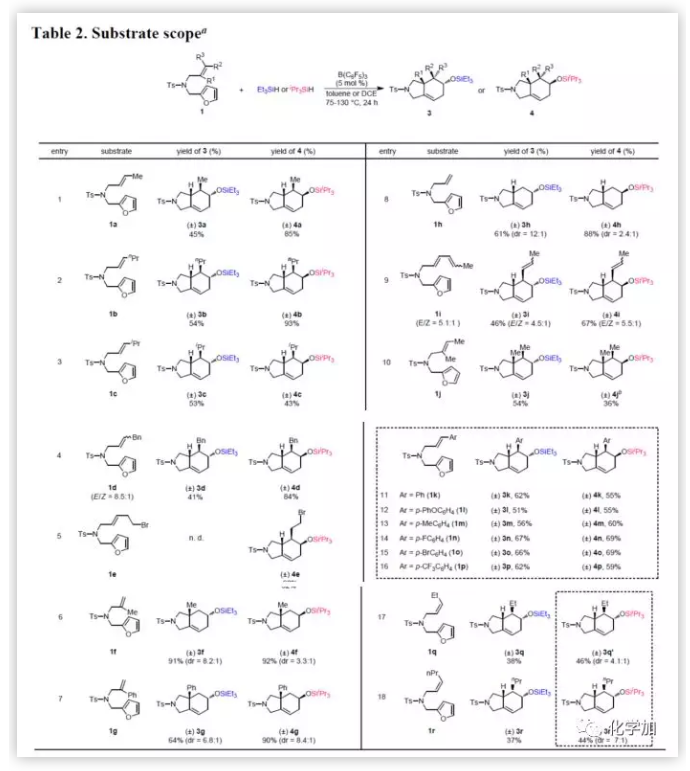
接下來,作者通過多種底物1與Et3SiH或iPr3SiH反應,研究硅烷基對串聯反應選擇性的影響(Table 2)。1a可與兩種硅烷反應,分別獲得3a(45%)和4a(85%)(entry 1)。當E-烯烴上的取代基改為正丙基、異丙基或芐基(1b-1d)時,串聯反應會根據氫硅烷的不同獲得相應的異構體(entries 2-4)。但是,溴乙基取代的底物1e與Et3SiH反應獲得復雜的混合物,而與iPr3SiH反應則獲得62%收率的4e(entry 5)。此外,1,1-二取代的烯烴1f和1g同樣可以進行反應,獲得具有手性中心的產物(entries 6-7),這些手性產物(3f、3g和4g)具有良好非對映選擇性,但4f的dr相對較低。在選擇無空間位阻的底物1h時,作者發現,與Et3SiH反應具有高選擇性,而與iPr3SiH反應則表現出較差的選擇性(entry 8)。具有共軛二烯(1i)的底物,近端烯烴優先發生環化,得到六氫異吲哚3i和4i(entry 9)。令作者驚訝地的是,對于具有多位阻的三取代烯烴的底物1j同樣可以取得較好的結果(entry 10)。此外,芳環上取代基不受電子效應影響,一系列帶有末端芳基的底物(entries 11-16)均能順利的反應。有趣的是,當使用含有Z-烯烴的底物與Et3SiH和iPr3SiH反應,獲得與產物相同的非對映異構體(entries 17-18)。
(圖片來源:J. Am. Chem. Soc.)
為了研究反應機理,特別是硅烷基控制選擇性的起源,作者進行了多組對照實驗(Figure 2)。首先,使Et3SiD與1a在標準條件下反應,Et3SiD中的氘被轉移到環己烯的烯丙基位置(Figure 2a),表明烯烴中氫化物加成與Diels-Alder環加成中間體已經產生。相反,iPr3SiD的氘被轉移到與甲硅烷氧基相連的碳上(Figure 2b),說明4a可能是酮氫化硅烷化的產物。接下來,作者在5-位上用氘標記呋喃,氘代1a與Et3SiH反應后,氘仍處于該位置(Figure 2c),但使用iPr3SiH時,氘轉移到相鄰的碳上(Figure 2d)。這些實驗表明,該反應是通過兩種不同的途徑進行。作者推測,Et3SiH的反應可能涉及呋喃Diels-Alder環加成反應和醚斷裂串聯過程,而與iPr3SiH的反應可能涉及1,2-氫遷移和酮氫化硅烷化的過程。
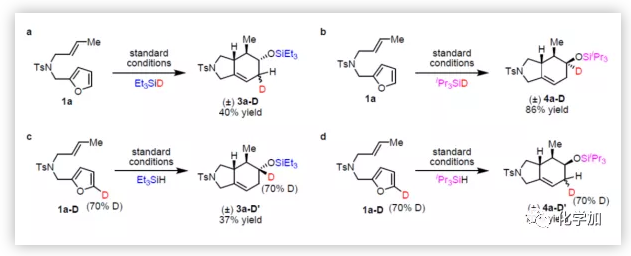
(圖片來源:J. Am. Chem. Soc.)
此外,呋喃Diels-Alder環加成反應生成的中間體,可對機理的正確性進行進一步的驗證。因此作者從無空間位阻的底物1h著手,合成環加成中間體2h。底物2h與Et3SiH在80 ℃下反應1小時獲得83%收率的串聯產物3h(Figure 2e),而與iPr3SiH反應僅獲得9%收率的4h,而酮5則為主產物(Figure 2f)。此外,2h在B(C6F5)3催化下80 ℃加熱1小時,獲得90%收率的5(Figure 2g)。這些結果表明,與iPr3SiH的串聯反應是經酮5中間體(由B(C6F5)3促進2h開環產生)。5與iPr3SiH在一當量的B(C6F5)3催化下反應1小時,獲得77%收率的4h(Figure 2h),其選擇性與串聯反應所觀察到的結果相同(Table 2, entry 8)。然而,當使用催化量的B(C6F5)3時,獲得收率極低的4h以及未反應的原料(Figure 2i)。這些結果表明,相對于催化劑而言,過量5會抑制氫化硅烷化反應,可能是因為5與iPr3SiH和B(C6F5)3的配位時存在競爭關系。因此,在1h與iPr3SiH的串聯反應中,5的濃度必須保持較低。另一組對照實驗中,作者發現,5與Et3SiH反應,生成了非對映異構體混合物(Figure 2j)。考慮到1h與Et3SiH串聯反應表現出優異的非對映選擇性(Table 2, entry 8),作者得出結論,與Et3SiH的串聯反應,僅通過氧橋的硅烷基化斷裂進行,而不是通過酮中間體的氫化硅烷化進行。
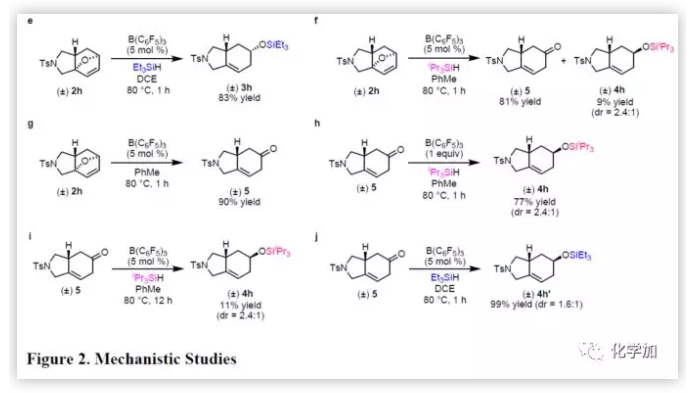
(圖片來源:J. Am. Chem. Soc.)
基于上述實驗結果,作者首先提出底物1a與Et3SiH反應機理(Figure 3a)。在1a與Et3SiH的串聯反應中,環加成中間體2a與硼烷活化的氫硅烷絡合物6反應,得到離子對7(硅烷基離子與氧橋鍵合),隨后開環并將負氫轉移至烯丙基碳正離子8上,從而獲得產物3a,并使催化劑再生。
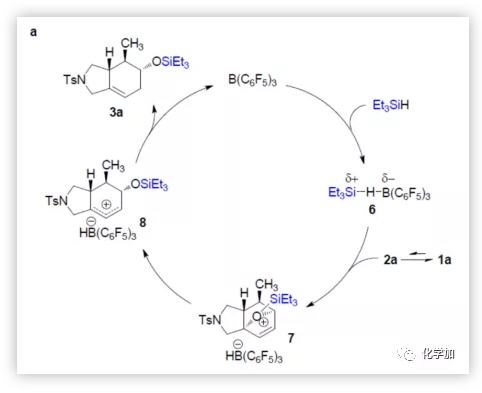
(圖片來源:J. Am. Chem. Soc.)
隨后,作者提出了底物1a與iPr3SiH反應的機理,涉及兩個催化循環過程(Figure 3c)。在循環A中,B(C6F5)3與2a的氧橋結合形成絡合物9,經醚鍵斷裂產生兩性離子中間體10,再經1,2-氫遷移得到硼烷-酮配合物11。B(C6F5)3從11上解離生成酮12,該酮進入催化循環B,即硼烷催化的酮氫化硅烷化反應。在此循環中,負氫從HB(C6F5)3-轉移至14中位阻較小羰基的一面,從而觀察到4a的立體化學特征。
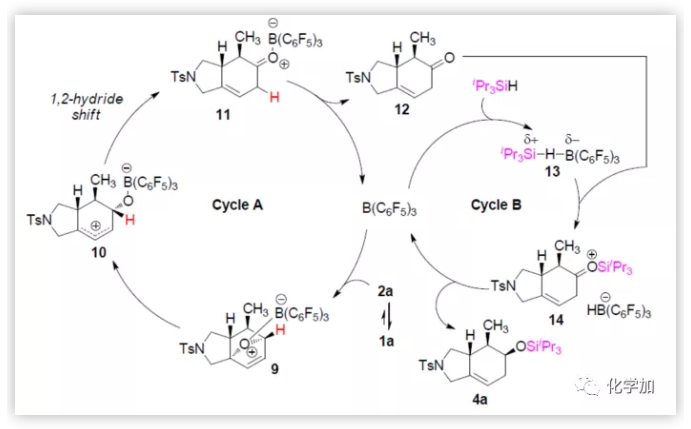
(圖片來源:J. Am. Chem. Soc.)
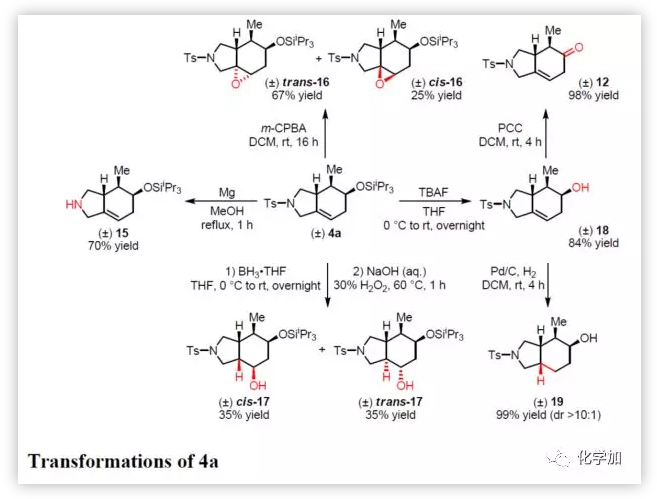
最后,作者通過對4a的后期修飾以證明該方法的實用價值(Figure 4)。如4a與鎂反應,很容易去除對甲苯磺酰基保護基,生成游離胺15。而使用m-CPBA氧化烯烴,可獲得環氧化物(反式-16和順式-16)。還可以通過硼氫化氧化獲得羥基化合物(順式17和反式17)。此外,硅烷基可以用TBAF斷裂,得到未保護的羥基化合物18(使用PCC氧化得到酮12或在Pd/C上氫化得到順式-雙環八氫異吲哚19,在兩種情況下產率都很高)。
(圖片來源:J. Am. Chem. Soc.)
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn