

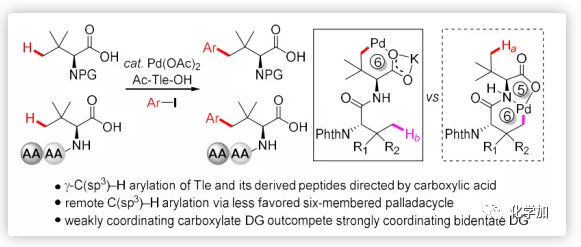
含大體積側鏈的氨基酸不僅是許多天然產物和藥物中的重要結構片段如Saxagliptin和Asunaprevir等(Figure 1a),還是通過外配位(Figure 1b)或內配位途徑(Figure 1c)進行對映選擇性C-H官能團化的有效手性配體。最早,Hashimoto課題組將一系列鄰苯二甲酰亞胺保護的氨基酸衍生物作為二銠(II)絡合物的有效配體用于carbenoid的對映選擇性C-H插入。大體積叔亮氨酸(Tle)衍生的催化劑Rh2(S-NTTL)4通常具有最佳的對映體控制,除氨基酸側鏈的空間體積外,鄰苯二甲酰亞胺保護基的種類在不對稱誘導中也起關鍵作用;Müller和Dauban等人報道1,8-萘甲酰基保護的Tle衍生的催化劑Rh2(S-NTTL)4是進行高度非對映選擇性分子間C-H胺化的最佳催化劑;Davies課題組合成了大體積催化劑Rh2(S-PTAD)4和Rh2(S-TCPTAD)4用于carbenoid的不對稱C-H插入。最近,鄰苯二甲酰亞胺保護的大體積側鏈氨基酸也成為Cp*Co(III)-催化的C-H活化的常用手性配體;Cramer課題組報道了手性Cpx Ir(III)/Rh(III)和Phth-Tle之間的強協同效應可以實現膦氧化物的對映選擇性C-H官能團化。大體積側鏈氨基酸在Cp*Co(III)-催化的C-H活化中也表現出顯著的活性;Matsunaga課題組報道了由非手性Cp*Co(III)/雙氮原子保護的(S)-H2-BHTL催化的硫代乙酰胺的對映選擇性C(sp3)-H酰胺化反應。通過上述研究發現,側鏈的體積和保護基的結構都可以顯著影響不對稱誘導和反應性。然而,大體積氨基酸的有限利用度阻礙了不對稱C-H活化的進一步發展。因此,迫切需要開發新的合成策略用以構建含大體積側鏈的手性氨基酸。
毫無疑問,通過易得的大體積叔亮氨酸的直接官能團化可以快速實現氨基酸空間體積的增加,這可能在不對稱反應中得到廣泛的應用。盡管利用共價連接的外源導向基團(DG)對脂肪族羧酸衍生物進行直接官能化已經開展了充分的研究,但是由于羧基的弱導向能力導致的低反應性,在不引入外源DG情況下進行羧酸的脂肪族C-H鍵直接轉化仍然充滿挑戰。最近,余金權等人報道了經由動力學穩定的五元鈀環過渡態進行的鈀催化游離羧酸的β-C(sp3)-H官能團化。然而,利用弱配位羧酸鹽DG經由六元鈀環過渡態進行遠程C(sp3)-H功能團化尚未報道。近日,浙江大學史炳鋒課題組報道了鈀催化的羧酸鹽導向的γ-C(sp3)-H芳基化,可以通過熱力學不穩定的六元鈀環合成各種大位阻氨基酸(Figure 1d)。
(圖片來源:Chem. Sci.)
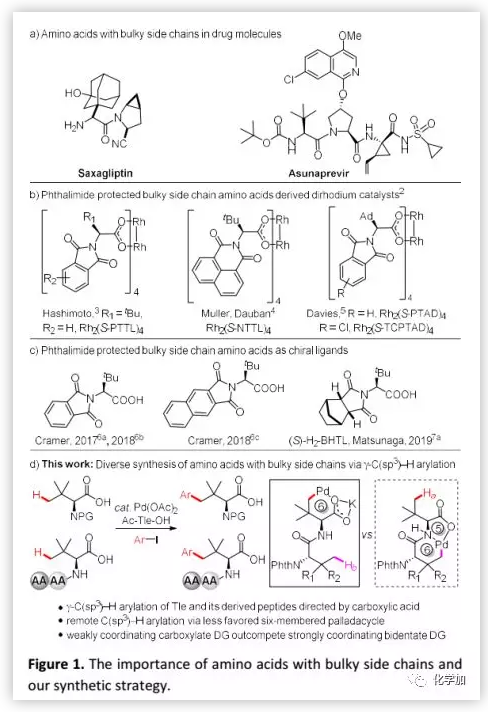
首先,作者以Phth-Tle-OH(1)與1-碘-4-甲氧基苯(2a)為模型底物篩選了一系列氮原子單保護的氨基酸配體,并發現以Ac-Tle-OH為配體時可以15%的收率得到芳基化產物3a。作者假設,Ac-Tle-OH中的大體積側鏈在反應中具有促進作用。隨后,作者通過對添加劑篩選發現:Ag3PO4可以促進反應使芳基化產物3a的收率提高至40%,Ag3PO4可能發揮雙重作用(鹵化物清除劑和異核活性物質利于C-H裂解)。通過對反應溫度的考察發現,反應溫度為70 ℃時最佳。當用3 e.q. 2a時,得到單芳基化產物3a(56%)和二芳基化產物3a'(15%);當以D-Ac-Tle-OH為配體時,結果類似(3a,57%;3a',14%)。最終,作者確定了以下1與2a之間的γ-選擇性芳基化條件(Conditions A):10 mol% Pd(OAc)2、30 mol% Ac-Tle-OH、1.0 e.q. K2CO3、1.0 e.q. Ag3PO4,在70 ℃ HFIP溶劑中敞口反應24 h。
在確定最佳反應條件后,作者考察了芳基碘化物的適用范圍(Figure 2)。在最佳反應條件下,含有吸電子基和給電子基的底物均可以良好的收率得到預期產物;在芳基碘化物的對位或間位可以耐受吸電子基團,例如乙酰基、甲氧羰基和甲酰基等;多取代的芳基碘化物也可以進行反應并以中等收率得到預期產物。此外,在最佳反應條件下,Phth-Ala-OH的β-C-H芳基化反應順利得到β-芳基化產物(51%)。
(圖片來源:Chem. Sci.)
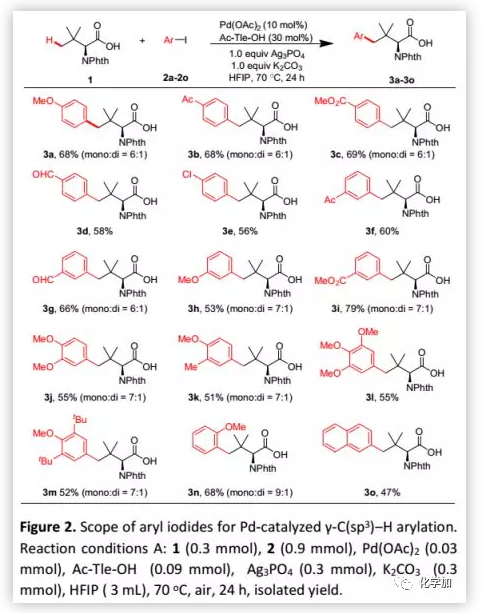
最近,過渡金屬催化的C-H活化已成為進行結構復雜多肽后期修飾的最有效策略之一。然而,多肽的C(sp3)-H官能團化主要取決于二齒DGs或多肽骨架的雙重配位。作者發現,在稍加改進的條件(Conditions B:Ag2SO4代替Ag3PO4)下,本方法對多肽是可行的:含有甘氨酸、環己甘氨酸和亮氨酸的二肽與2c順利反應并以中等收率得到芳基化產物。余金權課題組報道了多肽骨架的N,O-或N,N-雙配位作用下多肽中N端氨基酸的C-H活化。值得注意的是,弱配位的羧酸DG優于多肽骨架的強配位雙齒DG,并且選擇在Tle殘基的γ-C(sp3)-H鍵反應(Figure 3b)。此外,該方法也可以耐受三肽,但由于N,N-雙配位的競爭配位,使得收率較低(5g,34%;5h,23%)。其特殊的選擇性可能源于六元鈀環比5,6-稠合雙環更容易形成(Figure 3b,Int-A1 vs Int-B1; Int-A2 vs Int-B2)。當N-Phth-Ala-Tle-OH(4i,N端含有丙氨酸殘基的二肽)作為底物時,芳基化選擇性地發生在N端的β-甲基上。這種選擇性與余金權的報道一致,后者通過N,O-雙配位形成五元鈀環比通過單齒羧酸鹽DG形成六元鈀環更有利(Figure 3c,IntB3 vs Int-A3)。
(圖片來源:Chem. Sci.)
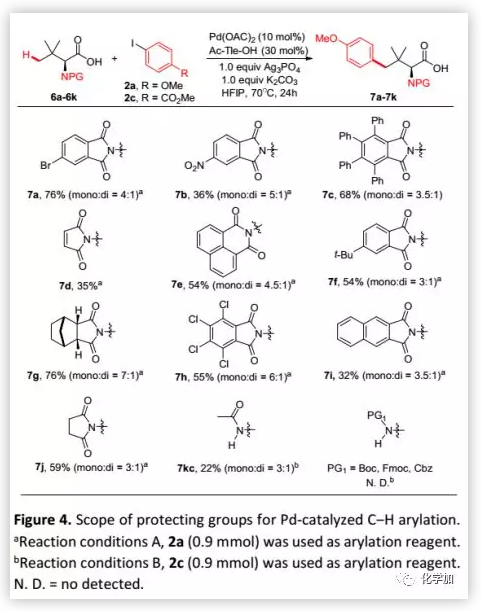
考慮到鄰苯二甲酰亞胺保護基在不對稱反應中具有重要影響,該方法需要與多種鄰苯二甲酰亞胺具有很高的兼容性。因此,作者考察了其他保護基在羧酸鹽導向的γ-C(sp3)-H芳基化反應中的耐受性(Figure 4),發現各種鄰苯二甲酰亞胺與均該反應相容并可以中等至高收率得到芳基化產物7,特別是可以耐受多種用于不對稱C-H活化的鄰苯二甲酰亞胺如1,8-萘甲酰基(7e)、7g、四氯鄰苯二甲酰基(7h)、2,3-萘甲酰基(7i)。琥珀酰亞胺保護的Tle(6j)也可以參與反應并以59%的收率得到預期產物7j。此外,Ac-Tle-OH也可以較低收率生成預期產物7kc(22%,mono: di = 3:1)。然而,烷氧羰基保護基如Boc、Fmoc和Cbz等不耐受該反應條件。
(圖片來源:Chem. Sci.)
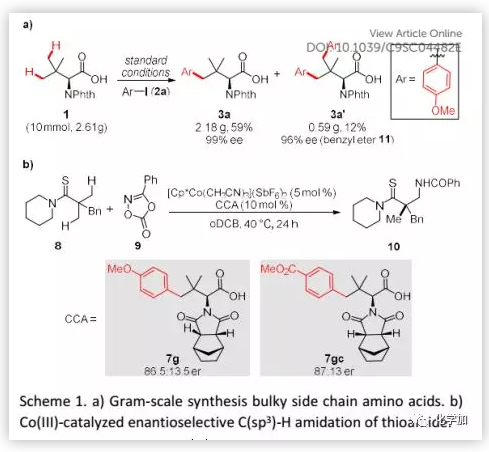
為了證明該方法的實用性,作者進行了3a的克級規模合成(Scheme 1a):1和2a反應以59%的收率得到3a(2.18 g)和12%的收率得到3a'(0.59 g),而沒有光學純度損失,這是作為手性配體應用的前提和必要條件。最后,作者通過使用所得的含大體積側鏈氨基酸作為手性配體進一步證明了該方法的實用性(Scheme 1b)。硫酰胺8與二噁唑酮9之間Co(III)-催化的C(sp3)-H酰胺化實驗結果表明,7g和7gc反應效率高且具有良好的對映體控制(7g,86.5:13.5 er;7gc,87:13 er;(S)-H2-BHTL, 87:13 er7a)。這些結果表明,修飾的氨基酸在不對稱反應中具有很高的潛力,特別是考慮到保護基片段和芳基骨架這兩個位點易于多樣化修飾。
(圖片來源:Chem. Sci.)
小結:浙江大學史炳鋒課題組開發了一種鈀催化的羧酸鹽導向的γ-C(sp3)-H芳基化方法用于大量合成大體積側鏈的氨基酸和多肽,該方法是首個使用弱配位導向基團進行多肽的后期C(sp3)-H官能團化的案例。此外,通過該方法所得的含有大體積側鏈的氨基酸已成功用于不對稱C(sp3)-H活化中的手性配體。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn