- 首頁
- 資訊
復旦麻生明院士/張俊良教授團隊JACS:Pd-催化芳基三氟甲磺酸酯和炔烴之間的對映選擇性Heck反應
來源:化學加(ID:tryingchem) 2019-12-06
導讀:復旦大學麻生明院士/張俊良教授團隊近日首次報道了鈀催化的芳基三氟甲磺酸酯與炔烴之間不對稱Heck反應,該成果發表于近期J. Am. Chem. Soc.(DOI: 10.1021/jacs.9b10883)。
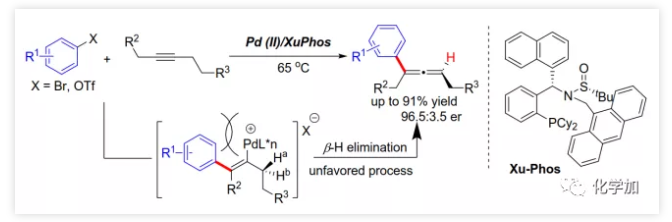
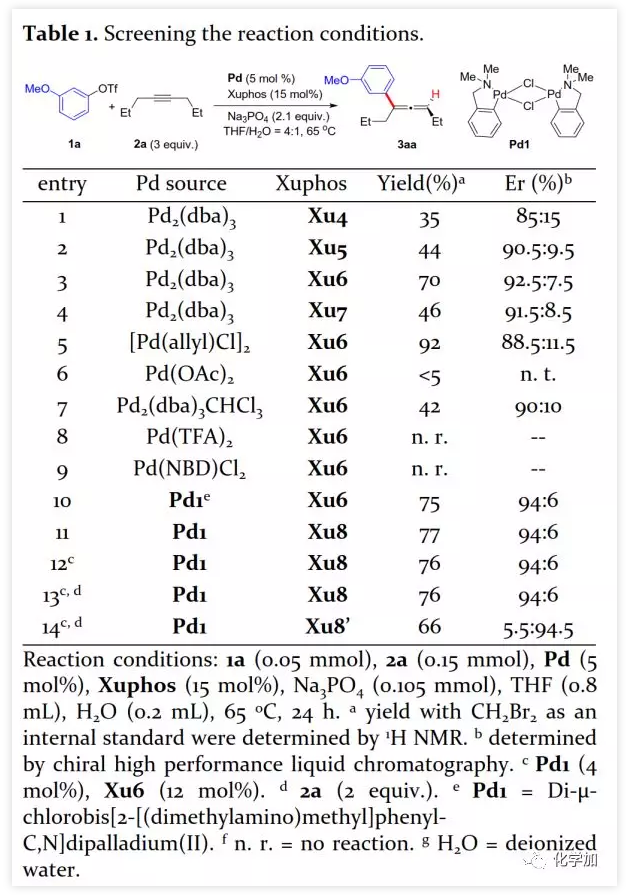
具有軸手性的聯烯片段存在于多種活性天然產物和藥物中。由于其具有獨特的反應性及其取代基的電性和空間效應,作為合成中間體可通過環加成、親核加成、氧化、交叉偶聯、環異構化等得到廣泛應用。通過將軸手性轉移至中心手性,可以獲得其他方法難以合成的手性分子。鑒于手性聯烯在有機合成中的重要性,構建手性聯烯的方法受到了廣泛關注。目前,已開發了多種構建手性三取代聯烯的策略,包括動力學拆分、手性轉移、去對稱化、不對稱重氮偶聯、異構化、不對稱Wittig反應、共軛烯炔以及炔丙基衍生物的不對稱羧化、不對稱環加成和環丙烯酮衍生物的不對稱轉化等。另一方面,通過烯烴的Heck反應構建C-C鍵是有機合成中最常見的方法。然而,由于乙烯基鈀的β-H消除在能量上不利,使得通過炔烴的Heck反應合成聯烯的方法滯后。1989年,Heck課題組首次在3-己炔和2-碘代苯甲酸甲酯的反應副產物中觀察到三取代聯烯(Scheme 1a)。隨后,Miura課題組利用鄰位取代的芳基溴在相關條件下進行了選擇性反應,可能由于鄰位取代的芳基與乙烯基鈀的PdLn之間空間位阻的增加在能量上有利于β-H消除。Hamblett課題組開發了一種芳基氯與炔烴的分子內Heck環化反應通過配體轉換選擇性地合成聯烯或共軛二烯。2014年,Larini、Jazzar等人利用新的配體(DFOTP)借助堿的去質子化而非Heck型鈀催化的β-H消除實現了芳基溴化物和炔烴之間的偶聯得到聯烯。2018年,Frantz課題組報道了水溶性dba配體/Pd(0)催化的芳基三氟甲磺酸酯和炔烴之間的Heck反應,可以在溫和條件下得到三取代聯烯。2019年,程國林課題組首次報道了鄰位取代的芳基碘化物與1-芳基-1-炔烴之間的區域選擇性碳鈀化。然而,當用dArFpe作為配體時,Morandi發現炔烴發生碘代而非Heck反應。時至今日,由于缺乏合適的手性配體來促進不利的β-H消除以及控制對映選擇性,鈀催化的芳基三氟甲磺酸酯和炔烴之間的對映選擇性Heck型反應尚未報道。最近,張俊良教授課題組開發的一系列含柔性亞磺酰胺片段的新型手性膦配體(即Sadphos)在鈀催化的不對稱交叉偶聯反應、還原性Heck反應及相關串聯反應中表現出了良好的性能。為了進一步拓展這些新手性配體的應用,作者嘗試將其用于芳基鹵化物或三氟甲磺酸酯與炔烴的不對稱Heck反應,但存在以下挑戰:1)如何控制產物比例(Heck反應產物與碘代產物);2)通過乙烯基鈀的β-H消除生成乙炔在能量上是不利的,尋求合適的手性配體以獲得良好的收率和高對映選擇性將充滿挑戰;3)聯烯產物易發生異構化形成1,3-二烯產物;4)聯烯產物與有機鹵化物或三氟甲磺酸酯進一步發生Heck反應。結合文獻報道,復旦大學麻生明院士/張俊良教授團隊認為配體是解決上述問題的關鍵,該團隊近日首次報道了鈀催化的芳基三氟甲磺酸酯與炔烴之間不對稱Heck反應。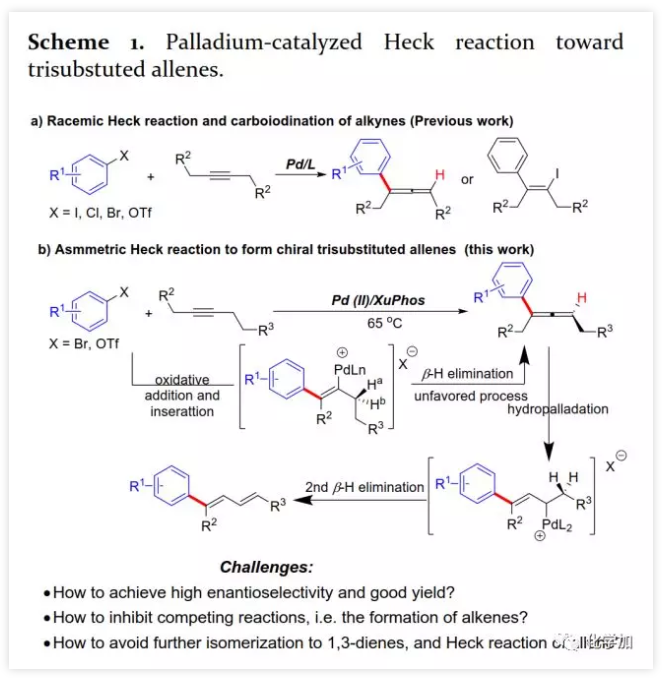 首先,作者以芳基三氟甲磺酸酯1a與炔烴2a之間的不對稱Heck反應作為模型反應對反應條件進行了篩選(Figure 1和Table 1)。作者考察了多個商業來源的手性配體如L1~L6均未能促進反應,篩選了一系列Sadphos配體如含有游離NH部分的Ming-Phos、Xiang-Phos、Wei-Phos和Xu-Phos也未能得到產物。受Frantz工作的啟發,作者認為增加配體的空間位阻可能促進乙烯基鈀的β-H消除。實際上,在磺酰胺部分引入甲基得到的Xu-Phos(Xu2和Xu3)可以催化該反應,收率為30-38%且具有中等對映選擇性(Figure 1)。因此,作者制備了一些含不同N-取代基的新Xu-Phos Xu4-Xu8(Table 1),發現Xu-Phos分子中氮原子上的保護基對對映選擇性和反應性有很大影響,其中較大的取代基反應性更好。最后,作者確定了以下最佳反應條件:以Pd2(dba)3為預催化劑、Xu6為手性配體、Na3PO4為堿,在65 ℃ THF/H2O中可以70%的收率得到3aa(92.5:7.5 er)。當用[Pd(allyl)Cl]2作為催化劑時,可以92%的收率得到3aa,但對映選擇性相對較低(88.5:11.5 er);當以Pd1為預催化劑時,可以73%的收率制備3aa(94:6 er);其他鈀催化劑產生的對映選擇性和收率較低,其中Pd(II)前體優于Pd(0);當用Xu8為配體時,得到的結果類似。將催化劑的負載量降至4 mol%時,得到的結果相同;將2a的用量減少至2 eq.時,也可以74%的收得到3aa(94:6 er)。此外,當以相應的對映體Xu8'為手性配體時,得到3aa的er值為5.5:94.5,即3aa的對映體是主要產物。
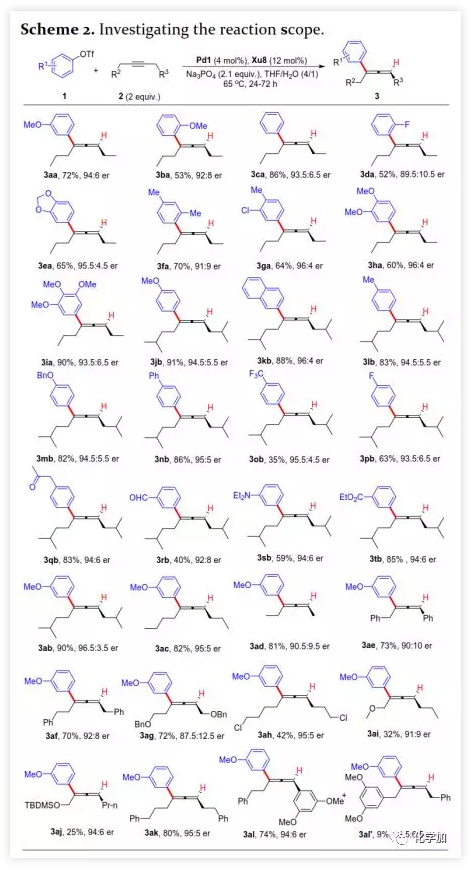
首先,作者以芳基三氟甲磺酸酯1a與炔烴2a之間的不對稱Heck反應作為模型反應對反應條件進行了篩選(Figure 1和Table 1)。作者考察了多個商業來源的手性配體如L1~L6均未能促進反應,篩選了一系列Sadphos配體如含有游離NH部分的Ming-Phos、Xiang-Phos、Wei-Phos和Xu-Phos也未能得到產物。受Frantz工作的啟發,作者認為增加配體的空間位阻可能促進乙烯基鈀的β-H消除。實際上,在磺酰胺部分引入甲基得到的Xu-Phos(Xu2和Xu3)可以催化該反應,收率為30-38%且具有中等對映選擇性(Figure 1)。因此,作者制備了一些含不同N-取代基的新Xu-Phos Xu4-Xu8(Table 1),發現Xu-Phos分子中氮原子上的保護基對對映選擇性和反應性有很大影響,其中較大的取代基反應性更好。最后,作者確定了以下最佳反應條件:以Pd2(dba)3為預催化劑、Xu6為手性配體、Na3PO4為堿,在65 ℃ THF/H2O中可以70%的收率得到3aa(92.5:7.5 er)。當用[Pd(allyl)Cl]2作為催化劑時,可以92%的收率得到3aa,但對映選擇性相對較低(88.5:11.5 er);當以Pd1為預催化劑時,可以73%的收率制備3aa(94:6 er);其他鈀催化劑產生的對映選擇性和收率較低,其中Pd(II)前體優于Pd(0);當用Xu8為配體時,得到的結果類似。將催化劑的負載量降至4 mol%時,得到的結果相同;將2a的用量減少至2 eq.時,也可以74%的收得到3aa(94:6 er)。此外,當以相應的對映體Xu8'為手性配體時,得到3aa的er值為5.5:94.5,即3aa的對映體是主要產物。 在確定最佳反應條件后,作者考察了各種芳基三氟甲磺酸酯和炔烴(Scheme 2)。在標準條件下,含吸電子基和給電子基的芳基三氟甲磺酸酯均可以良好的對映選擇性得到相應產物,而含吸電子基的缺電子芳基三氟甲磺酸酯則表現出較低的反應性(Table 2)。間位和對位取代的芳基三氟甲磺酸酯反應相似,但鄰位取代的芳基三氟甲磺酸酯需要更長的反應時間且對映選擇性相對較低,Xu6的性能優于Xu8。在反應條件下,含有酯、醛、酮和N-原子保護的氨基等官能團的底物均可以耐受,為進一步修飾提供了位點。由于在消除過程中氧原子與金屬中心配位的緣故,含有醚結構的炔烴的對映選擇性較低。此外,非對稱炔烴通過不同的區域選擇性Heck反應得到兩種產物(3al,3al'),但由于反區域選擇性Heck反應產生不穩定的聯烯基醚,只以低收率分離得到單一產物(3ai,3aj)。最后,通過聯烯3ca的比旋光度與文獻數據比較,將產物的絕對構型定為S。此外,作者在1-芳基-1-烷基炔烴的反應中未得到聯烯產物(eq 1);對于環狀炔烴,只得到環狀共軛二烯而非聯烯,這表明環狀聯烯產物在反應條件下易進一步異構化(eq 2)。作者還考察了芳基溴和芳基碘底物,其中芳基溴1u與2b的反應可以35%的收率得到聯烯產物(93.5:6.5 er)。為了研究其反應機理,在不加Na3PO4的情況下,作者用化學計量的催化劑將1a和2a反應,并以31% NMR的收率得到3aa,這排除了借助堿的不對稱去質子化途徑的可能性(eq 4)。 最后,作者進行了1a和2b之間的克級規模反應并以84%的收率得到4a(96:4 er)(Scheme 3,a);含硅醚保護基的手性三取代聯烯3aj經脫保護后,在金催化劑的催化下環化得到手性2,5-二氫呋喃5(93:7 er)(Scheme 3,b);Rh(III)-催化的N-甲氧基苯甲酰胺6與手性三取代聯烯3ab的逐步鄰位烯丙基化得到產物7(95.5:4.5 er)(Scheme 3,c)。根據手性配體Xu8的結構、Sadphos與鈀的絡合方式和產物S-3aa的絕對構型,作者提出了手性誘導模型(Figure 2)。小結:復旦大學麻生明院士/張俊良教授團隊開發了一種鈀催化的芳基三氟甲磺酸酯和炔烴之間的不對稱Heck反應,通過含較大位阻N-取代基的Xu-Phos的利用使在能量上不具優勢的乙烯基鈀的β-H消除得以順利進行。該反應在溫和條件下可以中等至高收率得到含各種官能團的手性三取代聯烯,其er值最高可達96.5: 3.5。此外,通過將軸手性轉移至中心手性,可以為構建分子的手性提供不可替代的方法。
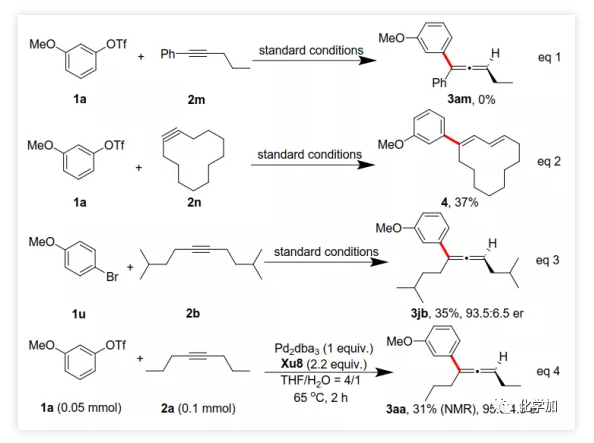
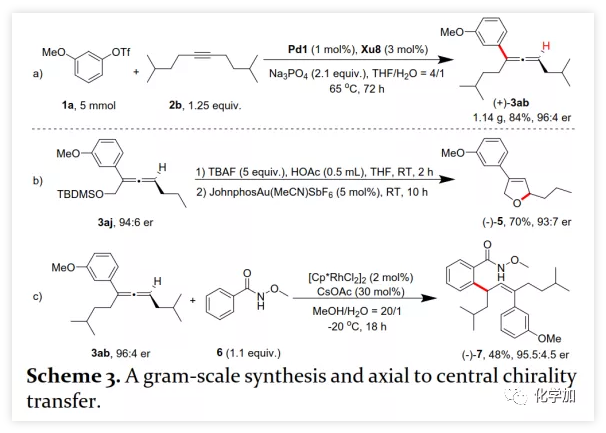
在確定最佳反應條件后,作者考察了各種芳基三氟甲磺酸酯和炔烴(Scheme 2)。在標準條件下,含吸電子基和給電子基的芳基三氟甲磺酸酯均可以良好的對映選擇性得到相應產物,而含吸電子基的缺電子芳基三氟甲磺酸酯則表現出較低的反應性(Table 2)。間位和對位取代的芳基三氟甲磺酸酯反應相似,但鄰位取代的芳基三氟甲磺酸酯需要更長的反應時間且對映選擇性相對較低,Xu6的性能優于Xu8。在反應條件下,含有酯、醛、酮和N-原子保護的氨基等官能團的底物均可以耐受,為進一步修飾提供了位點。由于在消除過程中氧原子與金屬中心配位的緣故,含有醚結構的炔烴的對映選擇性較低。此外,非對稱炔烴通過不同的區域選擇性Heck反應得到兩種產物(3al,3al'),但由于反區域選擇性Heck反應產生不穩定的聯烯基醚,只以低收率分離得到單一產物(3ai,3aj)。最后,通過聯烯3ca的比旋光度與文獻數據比較,將產物的絕對構型定為S。此外,作者在1-芳基-1-烷基炔烴的反應中未得到聯烯產物(eq 1);對于環狀炔烴,只得到環狀共軛二烯而非聯烯,這表明環狀聯烯產物在反應條件下易進一步異構化(eq 2)。作者還考察了芳基溴和芳基碘底物,其中芳基溴1u與2b的反應可以35%的收率得到聯烯產物(93.5:6.5 er)。為了研究其反應機理,在不加Na3PO4的情況下,作者用化學計量的催化劑將1a和2a反應,并以31% NMR的收率得到3aa,這排除了借助堿的不對稱去質子化途徑的可能性(eq 4)。 最后,作者進行了1a和2b之間的克級規模反應并以84%的收率得到4a(96:4 er)(Scheme 3,a);含硅醚保護基的手性三取代聯烯3aj經脫保護后,在金催化劑的催化下環化得到手性2,5-二氫呋喃5(93:7 er)(Scheme 3,b);Rh(III)-催化的N-甲氧基苯甲酰胺6與手性三取代聯烯3ab的逐步鄰位烯丙基化得到產物7(95.5:4.5 er)(Scheme 3,c)。根據手性配體Xu8的結構、Sadphos與鈀的絡合方式和產物S-3aa的絕對構型,作者提出了手性誘導模型(Figure 2)。小結:復旦大學麻生明院士/張俊良教授團隊開發了一種鈀催化的芳基三氟甲磺酸酯和炔烴之間的不對稱Heck反應,通過含較大位阻N-取代基的Xu-Phos的利用使在能量上不具優勢的乙烯基鈀的β-H消除得以順利進行。該反應在溫和條件下可以中等至高收率得到含各種官能團的手性三取代聯烯,其er值最高可達96.5: 3.5。此外,通過將軸手性轉移至中心手性,可以為構建分子的手性提供不可替代的方法。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn