

(圖片來源:Angew. Chem. Int. Ed.)
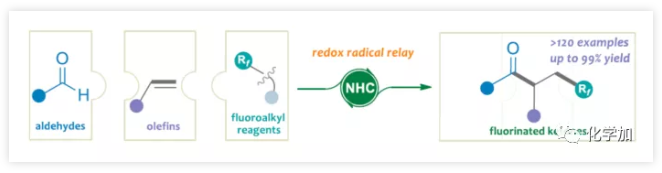
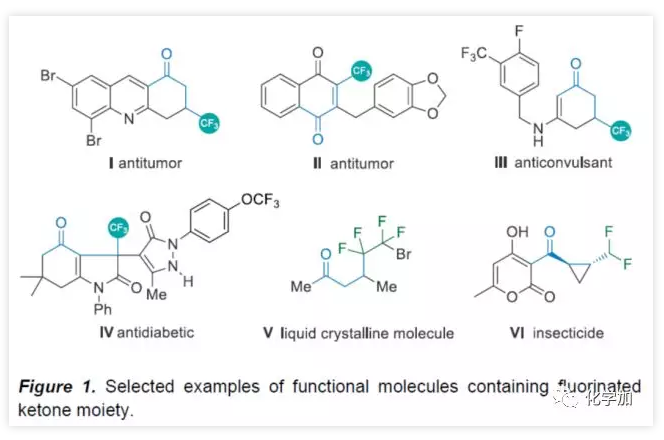
氟化物廣泛應用于藥物化學、農作物保護和材料科學領域,而將氟原子引入分子中,通常會對分子的滲透性、親脂性和代謝穩定性產生積極的影響。因此,合成各類含氟化合物已引起學術界和工業界的關注。氟代酮化合物作為候選藥物和功能材料中最受歡迎的結構之一(Figure 1)。例如,β-三氟甲基化酮(I?IV)可用于治療結腸癌、肺癌,同時還可作為抗驚厥藥和抗糖尿病藥。γ-二氟代酮V被用作液晶材料,VI具有出色的殺蟲活性。因此,開發高效實用方法合成氟代酮化合物具有重要意義。
(圖片來源:Angew. Chem. Int. Ed.)
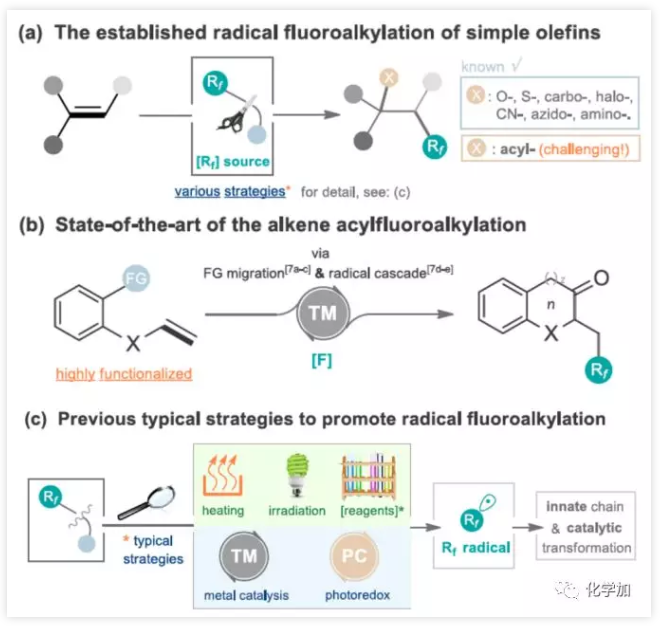
簡單烯烴的自由基氟代烷基化反應(烯烴雙鍵同時引入氟和其他官能團)作為合成復雜氟化分子高效方法。大量的烯烴雙官能化已經取得了重大進展(包括碳、氧、鹵、硫、氰基、疊氮基和氨基氟烷基化)。相比之下,通過簡單烯烴的自由基酰基氟烷基化直接合成氟代酮化合物具有挑戰性,并且開發不足(Figure 2a)。盡管自由基參與官能團遷移或分子內自由基偶聯反應已取得成功,但這些方法通常是由過渡金屬引起的,同時需要多步制備含羰基的烯烴底物(Figure 2b)。此外,一些促進氟代烷基化反應條件仍然存在一定的局限性,如加熱、紫外線照射、添加化學引發劑或氧化劑、過渡金屬催化等(Figure 2c)。因此,通過簡單烯烴經自由基催化體系實現酰基氟烷基化反應有待開發。
(圖片來源:Angew. Chem. Int. Ed.)
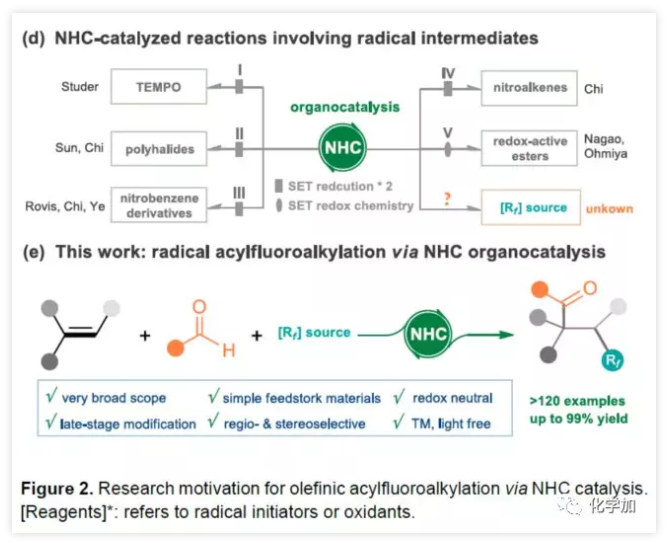
由于N-雜環卡賓(NHC)催化劑具有極性反轉的特性,可在離子化學中進行各種酰化反應。同時,一些課題組已公開了NHC參與的自由基反應,涉及連續兩次單電子還原的過程(Figure 2d)。最近,Nagao報告了醛與具有氧化還原活性酯經NHC催化實現自由基脫羧偶聯。在該反應中,去質子化的Breslow中間體(BI)可用作單電子還原劑,還原具有氧化還原活性的酯,并且可以將生成的烷基中間體與BI中間體重組,以產生交叉偶聯產物。考慮到這種情況,作者推測NHC參與單電子轉移(SET)也可能適用于各種氟代烷基,例如Togni試劑(產生自由基Rf),可能引起烯烴自由基加成,然后進行自由基與自由基的偶聯,從而實現簡單烯烴的自由基酰基氟烷基化反應(Figure 2e)。該方案具有廣泛的底物范圍、易于獲得的原料、優異的區域和非對映選擇性、無金屬自由基催化等優點。
(圖片來源:Angew. Chem. Int. Ed.)
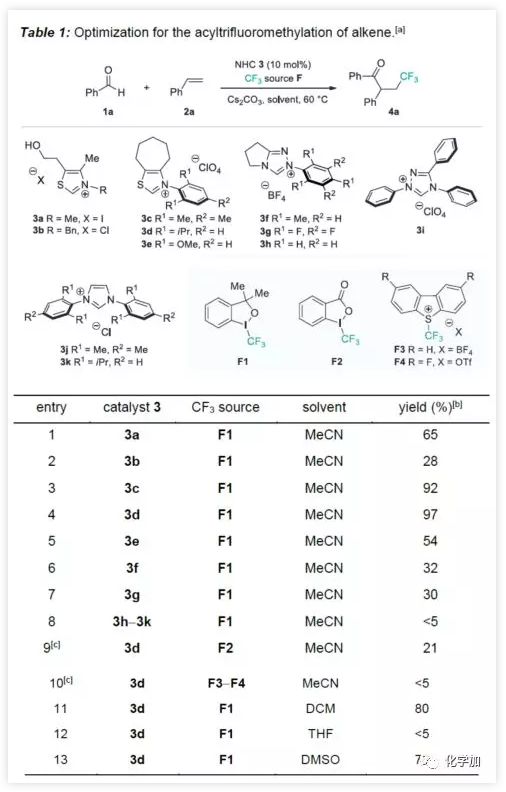
首先,作者以苯甲醛1a、苯乙烯2a和Togni I試劑F1作為模型底物進行了條件篩選(Table 1)。通過NHC催化劑的篩選(entries 1?8),NHC催化劑3d可獲得收率97%的4a,其他催化劑可能是由于催化效率低或者無法促進目標自由基的轉化導致收率偏低。而對其它CF3源(entries 9?10)和溶劑的篩選中(entries 11?13),收率均沒有提高。
(圖片來源:Angew. Chem. Int. Ed.)
在獲得上述最佳反應條件后,作者開始對底物進行了擴展(Table 2)。首先,以芳香醛1和苯乙烯2進行底物擴展。通過實驗,作者發現電子效應和定位效應對反應影響不大,均可獲得產率較高的氟代酮化合物(4a-4p),萘基和各種雜芳基醛(4q-4t)同樣適用于此體系。隨后,作者以苯甲醛與多種烯烴2進行相關驗證。在對位、間位和鄰位在苯環上同時帶有吸電子和給電子取代基的苯乙烯都可以參與該反應,獲得高收率的產物(4u-4aj)。值得注意的是,游離的羧基也與該反應相容,并以78%的產率獲得了相應的4ah。萘基、吲哚基或二茂鐵基取代的苯乙烯也能夠順利進行獲得相應的氟代酮(4ak-4am)。一些環狀烯烴,同時表現出有良好的非對映選擇性(4an-4ap)。此外,可以實現N-甲基吲哚的去芳化反應獲得三氟甲基化吲哚基酮(4aq-4at)。

(圖片來源:Angew. Chem. Int. Ed.)
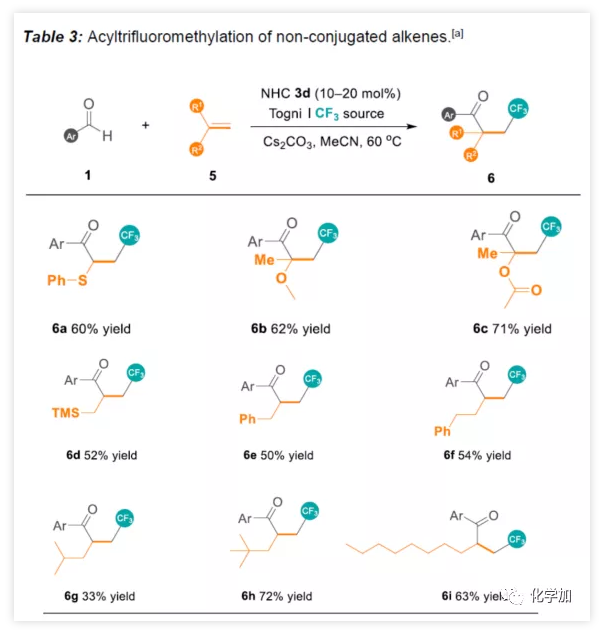
緊接著,作者開始嘗試苯甲醛與非共軛烯烴反應(Table 3)。苯基乙烯基硫醚能夠順利反應獲得60%收率的6a。1,1-二取代的乙烯基醚和乙烯基酯,可獲得四級立體中心的酮6b-6c。令人欣慰的是,一些未活化烯烴(6d-6f)和未官能化的末端烯烴(6g-6i)同樣可以獲得相應的產物。
(圖片來源:Angew. Chem. Int. Ed.)
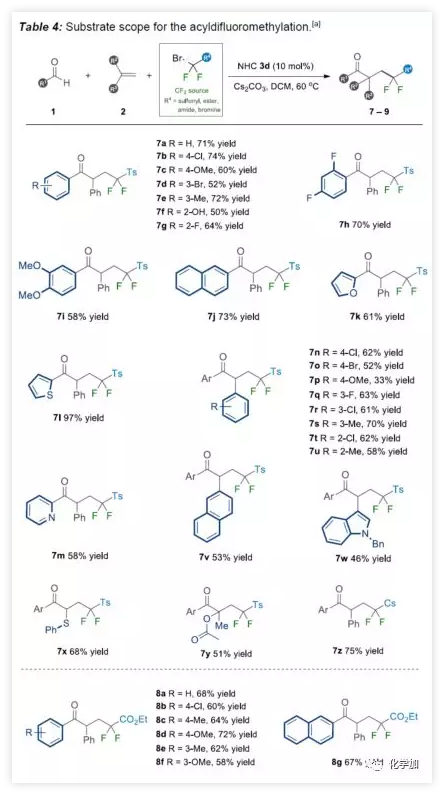
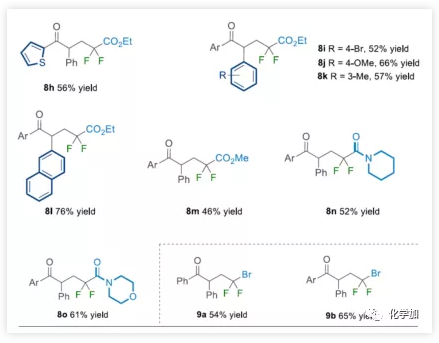
由于二氟化合物在現代有機氟化學中也起著重要作用,作者希望擴展NHC有機催化策略,實現烯烴的自由基酰基二氟烷基化反應。在上述催化條件下,對甲苯磺酰基(Ts)取代的溴代二氟甲基容易地與各種芳香醛和烯烴一起參與反應(Table 4)。底物擴展與上述結果基本一致。此外,廉價的二溴二氟甲烷可直接用作該NHC有機催化系統中獲得相應的γ-三鹵代酮衍生物(9a-9b)。
(圖片來源:Angew. Chem. Int. Ed.)
受烯烴二氟甲基化的影響,作者開始嘗試NHC催化的自由基全氟烷基化反應(Table 5)。實驗結果表明,具有不同長度的全氟烷基碘,通過上述方案可以輕松合成全氟酮10a-10d,產率56%-76%。
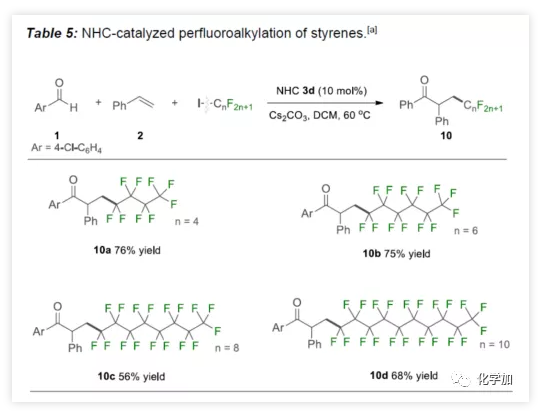
(圖片來源:Angew. Chem. Int. Ed.)
為了進一步證明該方案的實用性,作者對一些藥物骨架進行后期修飾(Table 6)。首先,非諾貝特(Fenofibrate)是臨床上最常見的降血脂藥物,通過上述方案,成功將酮和氟烷基引入非諾貝特中(11a?11f)。除了非手性藥物修飾之外,該方法還可以以非對映性的方式對藥物分子進行修飾。如雌酮(12)和生育酚衍生物(13)的酰基氟烷基化反應,兩者均含有手性中心,且骨架上的幾個化學鍵遠離苯乙烯部分,反映結果均表現良好的立體選擇性。三氟甲基化或二氟甲基化反應分別獲得目標分子12a-12f和13a-13f(滿足> 20:1的非對映選擇性比率)。
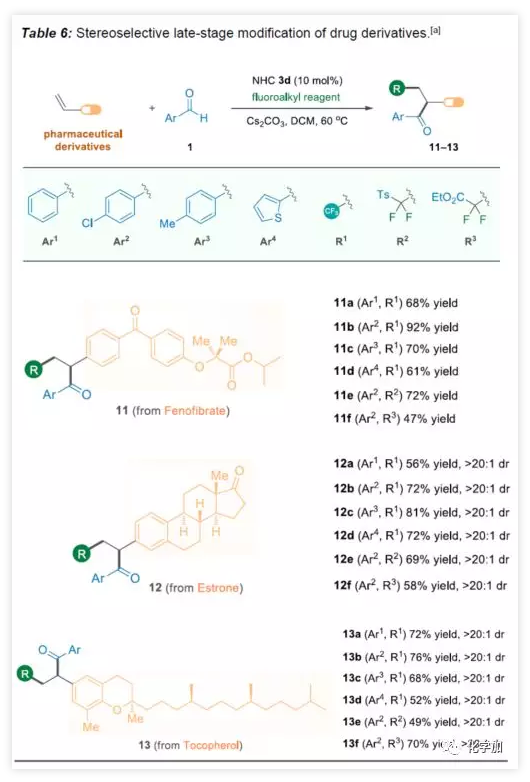
(圖片來源:Angew. Chem. Int. Ed.)
根據相關的對照試驗以及文獻的查閱,作者提出了一種可能的反應機理(Figure 3)。NHC催化劑與醛在堿性條件下,去質子化形成Breslow中間體I。然后,富電子I對氟代烷基試劑(Rf-X)進行單電子還原,生成了兩個自由基中間體(A和B)。最后,氟代烷基A與苯乙烯2a加成產生芐基C,通過自由基交叉偶聯(C與B的偶聯)獲得中間體II,隨后釋放NHC,產生氟代酮產物。
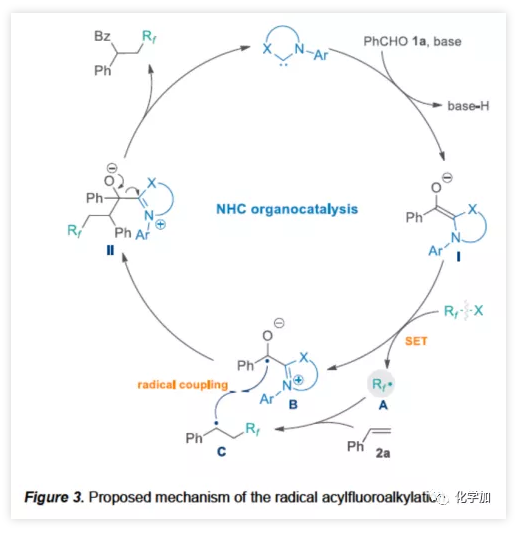
(圖片來源:Angew. Chem. Int. Ed.)
撰稿人:杉杉
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn