



澤布替尼誕生于北京昌平的百濟(jì)神州研發(fā)中心,2012年7月百濟(jì)神州研究團(tuán)隊正式對BTK開發(fā)項目立項,經(jīng)過一系列篩選與測試后最終在500多個化合物中,選定了最終候選分子編號BGB-3111,意為百濟(jì)神州成立后做出的第3111個化合物。

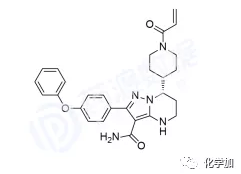
BRUKINSA是一款由百濟(jì)神州科學(xué)家自主開發(fā)的布魯頓氏酪氨酸激酶(BTK)小分子抑制劑(更多閱讀:抗癌靶點BTK及其抑制劑的研發(fā)進(jìn)展),目前正在全球進(jìn)行廣泛的關(guān)鍵性臨床試驗項目,作為單藥和與其他療法進(jìn)行聯(lián)合用藥治療多種B細(xì)胞惡性腫瘤。BRUKINSA于11月14日獲得美國食品藥品監(jiān)督管理局(FDA)批準(zhǔn)用于治療既往接受過至少一項療法的套細(xì)胞淋巴瘤(MCL)患者。
淋巴瘤是一組起源于B、T或NK細(xì)胞的含多種亞型的惡性腫瘤。套細(xì)胞淋巴瘤(MCL)通常是侵襲性的非霍奇金淋巴瘤(NHL),起源于“套區(qū)”的B細(xì)胞 [ii]。2019年,在美國預(yù)計約有74,200新增NHL病例,其中MCL新增病例為總數(shù)的6%(約4,452起)。套細(xì)胞淋巴瘤通常預(yù)后很差,中位生存期為三至四年 。套細(xì)胞淋巴瘤在診斷時通常已經(jīng)處于疾病晚期。
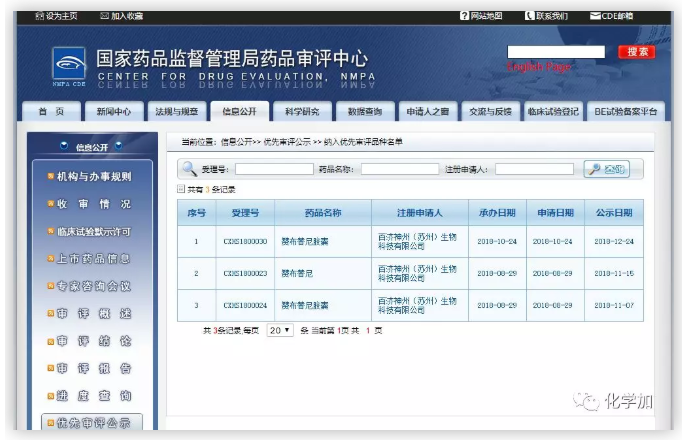
BRUKINSA用于治療復(fù)發(fā)/難治性(R/R)MCL患者和R/R慢性淋巴細(xì)胞白血病(CLL)或小淋巴細(xì)胞淋巴瘤(SLL)患者的兩項新藥上市申請(NDA)已被中國國家藥品監(jiān)督管理局(NMPA)納入優(yōu)先審評,正在審批過程中。
BRUKINSA在美國以外國家地區(qū)尚未獲批。
BRUKINSA獲得FDA批準(zhǔn)是基于兩項臨床試驗的有效性數(shù)據(jù),數(shù)據(jù)顯示BRUKINSA在參與兩項臨床試驗的患者中均產(chǎn)生高達(dá)84%的總緩解率(完全緩解和部分緩解綜合;ORR)。在澤布替尼用于治療復(fù)發(fā)/難治性(R/R)MCL患者的多中心的2期臨床試驗BGB-3111-206(clinicaltrials.gov登記號: NCT03206970)中,ORR為84%(95%置信區(qū)間:74%, 91%),包括59%的完全緩解(FDG-PET掃描在此項試驗中為必須)以及24%的部分緩解。此項試驗的中位持續(xù)緩解時間(DOR)為19.5個月(95%CI: 16.6, NE),中位隨訪時間為18.4個月。在全球1/2期臨床試驗BGB-3111-AU-003(clinicaltrials.gov登記號: NCT02343120)中,ORR為84%(95%置信區(qū)間:67%, 95%),包括22%的完全緩解(FDG-PET掃描在此項試驗中并非必須)以及62%的部分緩解。此項試驗的中位DOR為18.5個月(95% CI:12.6, NE),中位隨訪時間為18.8個月。 百濟(jì)神州創(chuàng)始人、首席執(zhí)行官兼董事長歐雷強先生表示:“我們致力于改善全球癌癥患者的治療,此次獲批使我們更接近實現(xiàn)為全球患者帶來最高質(zhì)量藥物的使命。緊接先前在這項適應(yīng)癥上獲得的突破性療法認(rèn)定,今天BRUKINSA獲得FDA上市批準(zhǔn)更是證明了其作為一項針對復(fù)發(fā)或難治性MCL治療方案的重要性。我們將繼續(xù)在其他血液腫瘤中對BRUKINSA進(jìn)行開發(fā),也希望此次獲批是為后續(xù)的眾多上市批準(zhǔn)首開先河。” 百濟(jì)神州高級副總裁、全球藥政事務(wù)負(fù)責(zé)人閆小軍女士評論道:“BRUKINSA作為一款BTK抑制劑,設(shè)計旨在最大化靶向占有率,同時避免脫靶效應(yīng)。BRUKINSA自2014年開啟廣泛的臨床項目以來,已入組1600多位患者。今天獲得加速批準(zhǔn)是百濟(jì)神州團(tuán)隊以及臨床試驗研究者們多年來付出的結(jié)果,但更重要的是要感謝參與臨床試驗的每位患者。我們很榮幸能有機會參與開發(fā)這款療法,使其成為百濟(jì)神州自主研發(fā)并被FDA批準(zhǔn)的首款抗癌藥物。” 中國北京大學(xué)腫瘤醫(yī)院大內(nèi)科主任、淋巴瘤科主任、醫(yī)學(xué)博士朱軍教授表示:“作為一名中國腫瘤臨床醫(yī)生,能夠見證由本土生物醫(yī)藥公司自主研發(fā)的創(chuàng)新抗癌藥首次獲得FDA批準(zhǔn)的歷史突破,我感到非常激動。這一突破是我國本土生物醫(yī)藥行業(yè)和臨床腫瘤研究的一個重要里程碑,標(biāo)志著我們不僅能為中國患者研發(fā)新藥,也能讓更多國家的患者受益其中,為世界提供中國的方案,貢獻(xiàn)中國的智慧。” 美國淋巴瘤研究基金會首席執(zhí)行官Meghan Gutierrez評論道:“澤布替尼作為一項治療MCL的二線療法獲批是在該適應(yīng)癥治療方案上的重大進(jìn)步。治療選擇的拓寬能夠幫助提高患者體驗,并為確診為MCL的患者帶來希望。”

來源 | 界面新聞、百濟(jì)神州、新京報
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn