NAD(P)H脫氫酶(NQO1) 是一種胞質(zhì)黃素酶,可以催化醌類化合物的減少以保護(hù)細(xì)胞免受氧化應(yīng)激,大量研究發(fā)現(xiàn)其在癌細(xì)胞中過表達(dá)。近年來,利用過表達(dá)NQO1的腫瘤細(xì)胞激活小分子前藥,有效提高了其治療效果。因此作者設(shè)計(jì)了一種含有醌丙酸(GPN)的化學(xué)配體來修飾蛋白賴氨酸,形成醌和蛋白偶聯(lián)物。GPN修飾和NQO1催化的GPN去除策略可適用于不同大小的蛋白,包括綠色熒光蛋白(GFP)、細(xì)胞色素c (Cyt c)和核糖核酸酶A (RNase A)。此外,GPN修飾Cyt c或RNase A,以及NQO1觸發(fā)的GPN去除,有效控制了蛋白活性。
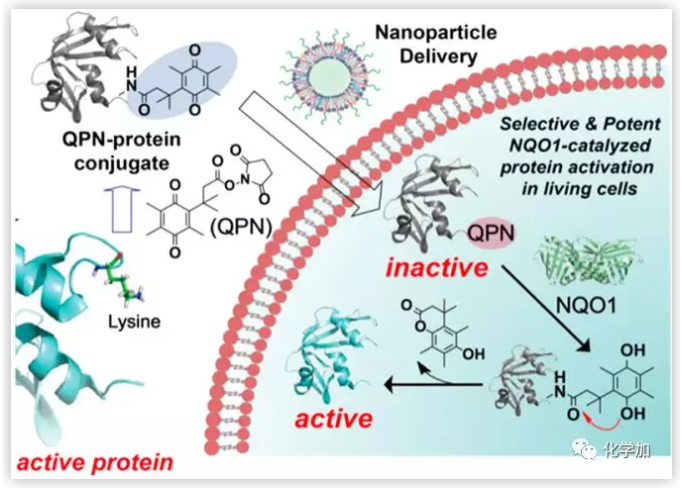
圖1. NQO1催化的蛋白質(zhì)的化學(xué)修飾及其在細(xì)胞內(nèi)的傳遞路徑,以激活活細(xì)胞中的蛋白質(zhì),實(shí)現(xiàn)潛在的靶向癌癥治療。(圖片來源:J. Am. Chem. Soc.)
作者合成了可與NQO1反應(yīng)的配體GPN和不含可與NQO1反應(yīng)部分的對照配體(PN)。首先在0.1 M NaHCO3溶液(pH 9.5)中以1:300的摩爾比將GFP與GPN或PN混合,然后反應(yīng)6 h,離心純化,使每個GFP分子平均與7個GPN或PN分子偶聯(lián)。然而,用NQO1處理GFP-GPN或GFP-PN時,蛋白質(zhì)的去甲基化結(jié)果有很大不同。GFP-GPN(50 μg /mL)與NQO1 (100 ng/mL)孵化可以使GPN有效從蛋白質(zhì)上去除,而當(dāng)GFP-PN同樣與NQO1孵化時沒有觀察到PN被去除,說明GPN修飾可以使NQO1特異性去除蛋白質(zhì)軛合物。
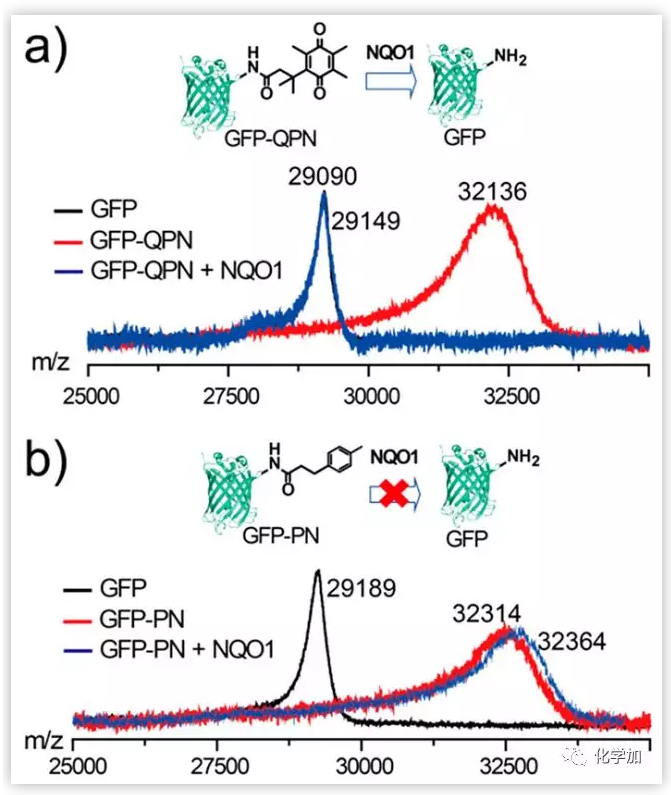
圖2. NQO1處理前后GFP-GPN (a)和GFP-PN (b)的MALDI-TOF(基質(zhì)輔助激光解吸/電離飛行時間質(zhì)譜分析)質(zhì)譜表征。(圖片來源:J. Am. Chem. Soc.)
接下來,作者研究了Cyt c和RNase A的GPN修飾,以進(jìn)一步證明該方法在開發(fā)NQO1響應(yīng)蛋白偶聯(lián)物和利用NQO1控制蛋白活性方面的普遍性。MALDI-TOF分析表明,GPN與上述蛋白混合后,GPN能有效修飾Cyt c和RNase A。通過對RNase A-GPN或RNase A-PN的蛋白水解消化和質(zhì)譜分析,詳細(xì)研究了RNase A的修飾位點(diǎn),發(fā)現(xiàn)GPN和PN偶聯(lián)導(dǎo)致多個賴氨酸殘基的修飾,這些修飾降低了蛋白活性。此外,RNase A的GPN或PN修飾對蛋白質(zhì)構(gòu)象的影響很小。重要的是,當(dāng)Cyt c-GPN或RNase A-GPN被NQO1處理時, GPN配體被有效去除。而使用NQO1處理Cyt c-PN或RNase A-PN時均未觀察到配體被去除。酶活性測定結(jié)果表明,GPN修飾Cyt c或RNase A的賴氨酸明顯降低了其活性,而NQO1處理有效恢復(fù)了蛋白活性。經(jīng)修飾的Cyt c- GPN和Cyt c- PN的酶活性降低到約5%。然而,與未和NQO1孵育相比,使用NQO1處理可使Cyt c-GPN活性增加20倍。此外,在NQO1處理下未觀察到Cyt c-PN活化。且當(dāng)兩種蛋白都被NQO1處理時,RNase A-GPN表現(xiàn)出NQO1調(diào)節(jié)的蛋白活性,但是RNase A-PN沒有。此外,當(dāng)Cyt c-GPN或RNase a - GPN在競爭性NQO1抑制劑(如雙香豆素)存在的情況下使用NQO1處理時,蛋白激活被顯著抑制。
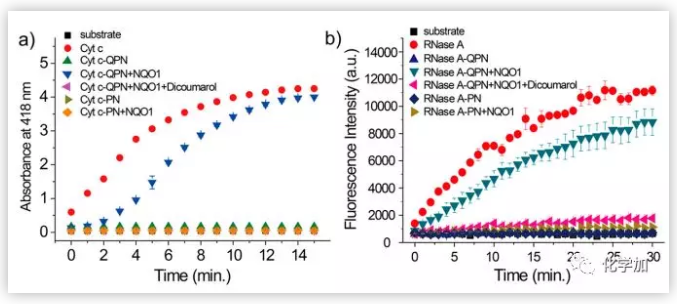
圖3.在有無NQO1抑制劑(雙香豆素)的情況下,用NQO1處理Cyt c-GPN (a)或RNase A - GPN (b)的酶活性測定。(圖片來源:J. Am. Chem. Soc.)
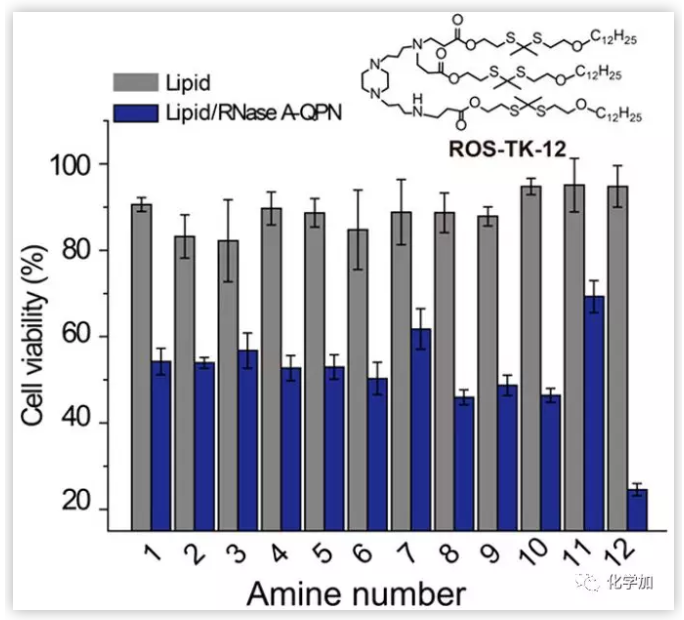
RNase A可以催化細(xì)胞內(nèi)RNA的水解,促進(jìn)細(xì)胞內(nèi)RNA的死亡。然而,腫瘤細(xì)胞特異性NQO1對RNase A-GPN活性的控制由于蛋白進(jìn)入細(xì)胞的低效率而被大大阻礙。因此,將蛋白偶聯(lián)物導(dǎo)入腫瘤細(xì)胞以激活NQO1并進(jìn)行靶向治療至關(guān)重要。作者合成了一個陽離子脂質(zhì)庫,并通過自組裝蛋白質(zhì)脂質(zhì)納米顆粒篩選了有效的蛋白質(zhì)遞送載體。最近,作者證明了將活性氧(ROS)可分裂的硫代乙二胺基轉(zhuǎn)移到脂質(zhì)納米顆粒中可以促進(jìn)細(xì)胞內(nèi)脂質(zhì)降解和癌細(xì)胞內(nèi)蛋白釋放,從而增強(qiáng)基因沉默。作者假設(shè)這種ROS增強(qiáng)的遞送策略同樣適用于遞送RNase A-GPN以促進(jìn)癌細(xì)胞內(nèi)蛋白的釋放,使NQO1催化的RNase A-GPN激活。因此作者利用脂質(zhì)納米顆粒和RNase A-GPN組成的自組裝納米復(fù)合物處理過表達(dá)NQO1的HeLa細(xì)胞,研究這些脂質(zhì)傳遞RNase A-GPN的能力。RNase A-GPN的高效遞送及胞內(nèi)NQO1的激活可抑制腫瘤細(xì)胞的生長,因此作者測量了脂質(zhì)/RNase A-GPN納米顆粒處理后HeLa細(xì)胞的活力,以比較不同脂質(zhì)處理的蛋白遞送效率。
圖4. RNase A-QPN的脂質(zhì)納米顆粒有效遞送的鑒定。(圖片來源:J. Am. Chem. Soc.)
為了進(jìn)一步驗(yàn)證細(xì)胞內(nèi)NQO1在激活RNase A-GPN中的關(guān)鍵作用,作者首先利用RNA干擾(RNAi)在ROS-TK-12/RNase A-GPN遞送前敲除HeLa細(xì)胞內(nèi)的NQO1。細(xì)胞內(nèi)NQO1水平的定量和比較結(jié)果顯示,與未處理的細(xì)胞相比,siNQO1處理(80 nM siRNA)使HeLa細(xì)胞中NQO1的表達(dá)降低了40%。此外,與未處理的細(xì)胞相比,siNQO1處理使HeLa細(xì)胞中的NQO1活性降低了55%,而阻止siRNA的傳遞并沒有導(dǎo)致NQO1表達(dá)下調(diào)。siNQO1轉(zhuǎn)染的HeLa細(xì)胞用ROS-TK-12 /RNase A-GPN納米顆粒進(jìn)一步處理。結(jié)果表明,與未轉(zhuǎn)染siNQO1的HeLa細(xì)胞相比,轉(zhuǎn)染siNQO1的HeLa細(xì)胞對ROS-TK-12/RNase a - GPN的細(xì)胞毒性明顯降低。由于上述發(fā)現(xiàn),作者進(jìn)一步研究了NQO1刺激因子蘿卜硫素的存在是否能刺激NQO1低表達(dá)細(xì)胞系HEK293T中RNase a - GPN的激活。結(jié)果證明蘿卜硫素(1.33 μM)處理HEK293T細(xì)胞后細(xì)胞內(nèi)NQO1水平是沒有蘿卜硫素刺激的細(xì)胞的1.6倍。用ROS-TK-12 /RNase A-GPN納米顆粒處理對HEK293T細(xì)胞的細(xì)胞毒性很小,因?yàn)檫@些細(xì)胞中的低NQO1水平有效阻止了RNase A-GPN激活。然而,將ROS-TK-12/ RNase A-GPN轉(zhuǎn)染到蘿卜硫素預(yù)處理的HEK293T細(xì)胞后,細(xì)胞存活率比未處理的細(xì)胞降低了25%。
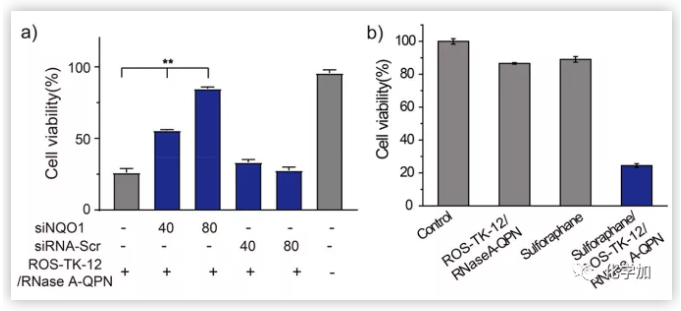
圖5.RNA干擾(a)或蘿卜硫素刺激HEK293細(xì)胞NQO1表達(dá)下調(diào)(b)有效調(diào)控了RNase A-GPN的激活,從而調(diào)控了ROS-TK-12/RNase A-GPN納米顆粒的對細(xì)胞的毒性。(圖片來源:J. Am. Chem. Soc.)
最后,作者研究了ROS-TK-12/RNase A-GPN納米粒子的體內(nèi)遞送,以證明其抗腫瘤作用。作者在BALB/c雌性小鼠左側(cè)腋窩皮下注射HeLa細(xì)胞,建立了HeLa宮頸癌異種移植瘤模型,再向HeLa荷瘤小鼠體內(nèi)注射了熒光標(biāo)記的ROS-TK-12/FITC-RNase AGPN納米顆粒,對小鼠器官進(jìn)行熒光成像。給藥6小時后,ROS-TK-12/ FITC-RNase A-GPN納米顆粒在腫瘤部位有效積累。相比之下,FITC-RNase A-GPN注射并未導(dǎo)致任何腫瘤靶向的蛋白遞送。作者又在HeLa腫瘤模型中比較了ROS-TK-12/RNase a - GPN納米顆粒對腫瘤生長的抑制作用,將ROS-TK-12/RNase A-GPN納米顆粒靜脈注射到荷瘤小鼠體內(nèi),同時以游離RNase AGPN或ROS-TK-12納米顆粒作為陰性對照。結(jié)果顯示,與用磷酸鹽緩沖鹽溶液(PBS)處理小鼠相比,游離RNase A-GPN或ROS-TK-12注射對腫瘤生長的抑制作用最小。與此形成鮮明對比的是,以每2天一次的頻率給藥5次ROS-TK-12/RNase A-GPN納米顆粒(2.5 mg/kg),可抑制腫瘤生長達(dá)80%。且與PBS注射相比,ROS-TK-12/RNase A-GPN納米顆粒治療小鼠的體重變化可以忽略不計(jì),也就說明該方法具有很高的生物相容性,可用于安全有效的癌癥治療。

圖6.ROS-TK-12/RNase A-GPN納米粒的體內(nèi)分布以及不同納米顆粒處理HeLa荷瘤小鼠的腫瘤生長曲線。(圖片來源:J. Am. Chem. Soc.)
總結(jié):中國科學(xué)院化學(xué)研究所汪銘課題組報(bào)道了一種簡便和通用的化學(xué)方法來修飾蛋白,并選擇性地控制NQO1高表達(dá)腫瘤細(xì)胞中的蛋白活性。通過使用響應(yīng)ROS的脂質(zhì)納米顆粒遞送蛋白,證明了NQO1誘導(dǎo)PPT激活對癌癥靶向治療的效力。RNase A-GPN的胞內(nèi)傳遞及其隨后被NQO1激活,有效地抑制了腫瘤細(xì)胞的生長。該方法增加了潛在有用的化學(xué)工具的數(shù)量,使用疾病細(xì)胞特異性酶可逆地控制蛋白質(zhì)的結(jié)構(gòu)和功能,為動態(tài)生物學(xué)過程的研究和精確的蛋白質(zhì)治療的發(fā)展提供了機(jī)會。