

唾液酸廣泛存在于糖蛋白及糖脂,在細胞相互作用、病原體—宿主識別中起關鍵作用。唾液酸中,N-乙酰神經酰胺(Neu5Ac)在自然界中通過α-(2,3),α-(2,6)糖苷鍵與半乳糖或半乳糖胺相連,或通過α-(2,8),α-(2,9),或交替的α-(2,8)/α-(2,9)糖苷鍵同聚。由于羧基的吸電子特性、季碳的異頭位中心及3-位羥基的缺失使立體選擇性地唾液酸化十分困難。傳統方法,包括替換異頭位的離去基團,引入新保護基,調控C-5氨基的電子效應等,存在底物適用性窄、選擇性對溫度敏感等缺點。因此,為滿足化學生物學發展需求,新型的唾液酸化方法依然有待發展。
疊氮基團多樣的反應活性使C-5疊氮唾液酸砌塊能滿足多樣化合成唾液酸分子的需求。然而,即使在氰基效應的影響下,該類砌塊仍無法立體選擇地生成糖苷鍵。但是,疊氮的強吸電子特性可以將異頭位氧鎓離子去穩定化,提高中間體通過鄰基參與過程反應的可能性。Pic基團已被廣泛用于唾液酸合成,其不僅可作為鄰基參與基團,也可作為氫鍵受體與糖基受體作用,此外,在Pic保護的唾液酸硫苷給體被活化時,曾有糖基OTf酯中間體產生的報道,其為糖苷化SN2型反應的重要中間體。江西師范大學孫建松研究員等人因此設計了5-疊氮-1-(2′-Pic)-唾液酸硫苷給體并將其用于唾液酸化,該給體的反應體現了優異的α-選擇性。作者通過實驗及理論計算明確了反應機理并首次確證了唾液酸1-位吸電子取代基對糖苷化立體選擇性的影響,相關成果發表在Angew. Chem. Int. Ed.上。
作者首先對糖基給體進行了合成(Scheme 1.),由1出發,在LiCl、吡啶條件下經Krapcho脫甲基后,在堿性條件下與PicBr發生酯化反應以2步80%收率得到給體2。

圖片來源:Angew. Chem. Int. Ed.
作者對后以2和3的糖苷化反應為模型反應進行條件優化(Table 1.),其中,HOTf的量對反應有關鍵影響,將酸增加至1.0當量后,反應以高收率得到偶聯產物(entry 3)。值得一提的是,反應的立體選擇性與酸的量無關。當以2α為給體時,盡管收率略降低,但該給體活性高、反應時間縮短(entry 4)。
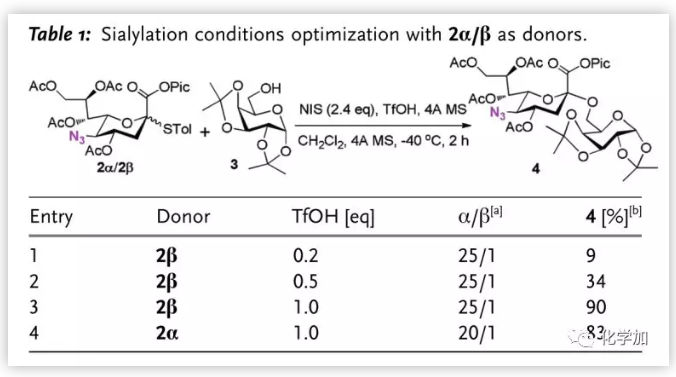
圖片來源:Angew. Chem. Int. Ed.
得到最優條件后,作者對伯醇受體進行了擴展(Table 2.),芐醇5、葡萄糖6-8均以高收率和α-選擇性完成糖苷化,8由于苯甲酰基電性的影響,需要高溫(-20 到 -10 oC)并延長反應時間(4 h)完成反應。2-疊氮-2-脫氧葡萄糖、甘露糖和半乳糖(9-11)6-位也能完成糖苷得到9-11。其中,鄰碘苯氧基(IP)作為MPEP的掩蔽形式,在該條件下是惰性的,為后期合成天線分子奠定了基礎。
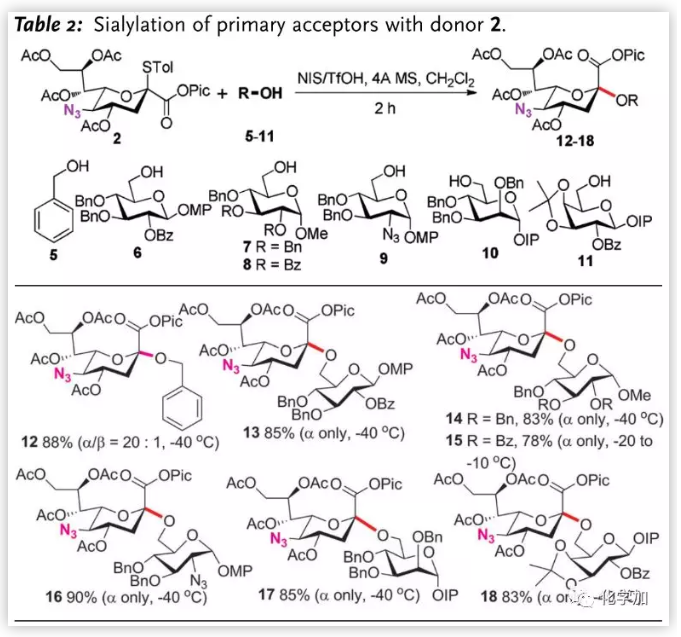
圖片來源:Angew. Chem. Int. Ed.
二級或三級羥基與唾液酸給體在糖苷化過程中,往往使用多個羥基裸露的受體以緩解位阻效應。而為驗證發展的糖苷化反應效率,作者嘗試了一系列單羥基裸露受體(Table 3.)。受限于弱親核性,除環己醇19和armed受體20外,其他受體的糖苷化反應均需升溫至-20 oC,但該變化不會影響立體選擇性。半乳糖受體23給出低收率的糖苷化產物31(42%),但將其4、6-位保護基換為芐叉后,收率提升(73%)。與Crich觀察的β-選擇性不同,作者以3:1的選擇性得到L-鼠李糖的α-唾液酸化產物。三級羥基金剛烷醇26同樣能以完全的α-選擇性得到糖苷化產物34。
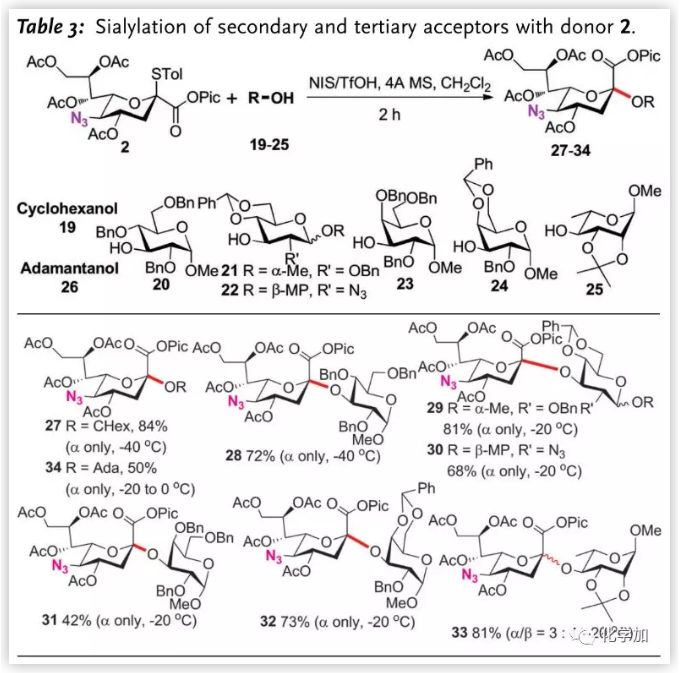
圖片來源:Angew. Chem. Int. Ed.
Neu5Ac的α-(2,8),α-(2,9)連接廣泛存在于糖蛋白中,但由于唾液酸8、9-位羥基的極弱親核性使該鍵成為最具挑戰性的糖苷鍵之一。作者嘗試使用該方法形成唾液酸α-(2,8),α-(2,9)糖苷鍵(Scheme 2.),在標準條件下,給體2與受體35及36能以完全的立體選擇性得到二糖37和38。
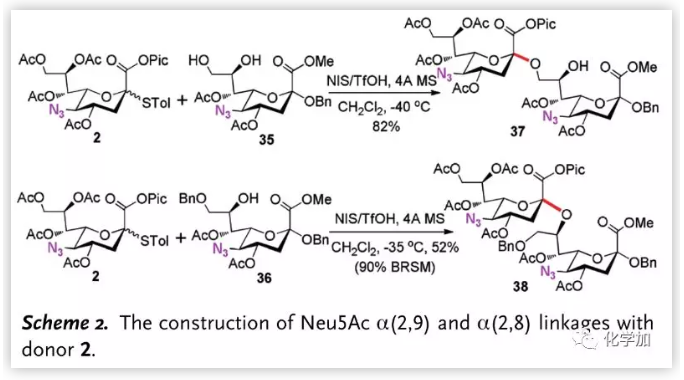
圖片來源:Angew. Chem. Int. Ed.
作者隨后嘗試脫除糖苷化產物的Pic基團(Table 4.)。在二氯甲烷/甲醇中,以Cu(OAc)2為螯合劑,無反應發生。將溶劑換為純甲醇并將溫度升高,作者成功以高收率將唾液酸二糖Pic酯轉化為甲酯,而底物中的其他基團不受影響。
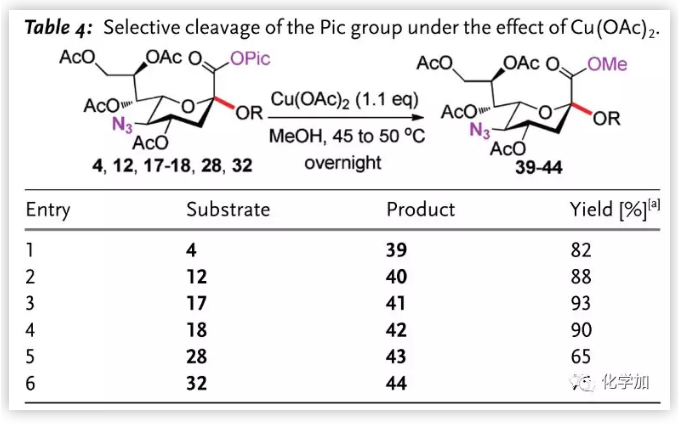
圖片來源:Angew. Chem. Int. Ed.
除Pic酯外,作者還對疊氮進行了轉化(Scheme 3.),在硫代乙酸與吡啶的存在下,14和42中的疊氮被順利轉化為自然界中存在的氨基乙酸;而為了將疊氮轉化為其他酰基,作者引入了試劑47,并分別將39和40中的疊氮轉化為芐氧乙酰基。
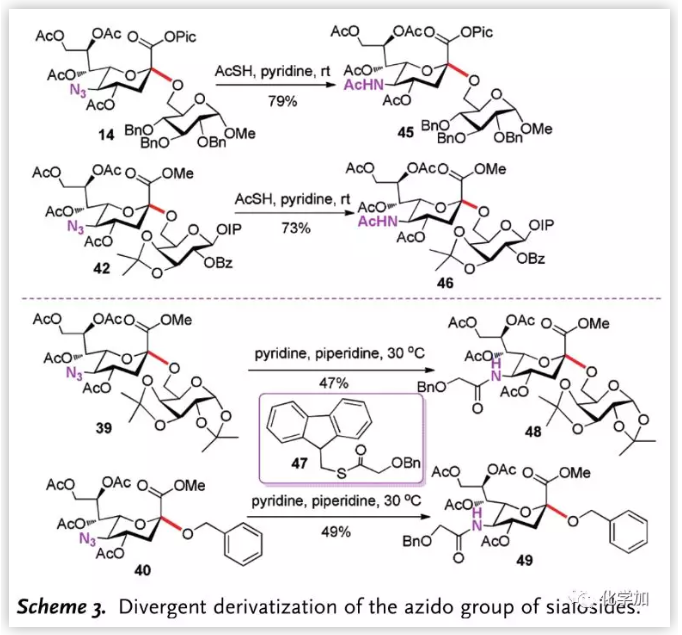
圖片來源:Angew. Chem. Int. Ed.
作者隨后結合此糖苷化反應與之前發展的MPEP“掩蔽—活化”策略并將其用于天線分子的合成。由2出發,其與半乳糖IP受體50發生糖苷化反應,以90%, α-選擇性得到二糖,將Pic和疊氮基團轉化后,通過Sonogashira反應將IP轉化為MPEP給體,隨后與55發生糖苷化反應,以83%收率得到三糖;再一次去掩蔽化將IP轉化為MPEP后與甘露糖58發生糖苷化反應,最終以7步最長線性步驟,29%總收率得到I型天線分子59。
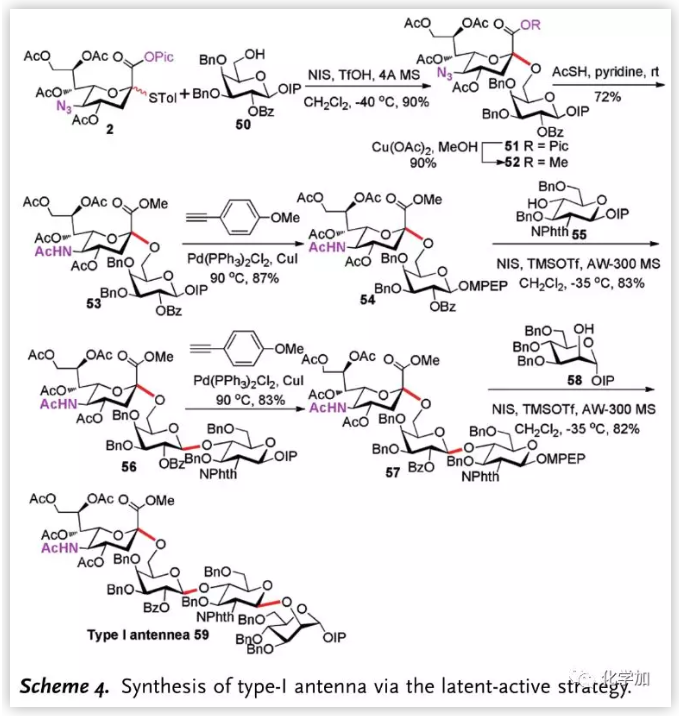
圖片來源:Angew. Chem. Int. Ed.
作者隨后對II型天線分子進行了合成,給體2與半乳糖受體60區域專一地與3-位羥基發生反應,以α-選擇性實現α-2,3糖苷鍵的構建,接著通過同樣的步驟,以最長線性步驟8步16%的總收率完成II型天線四糖的合成。
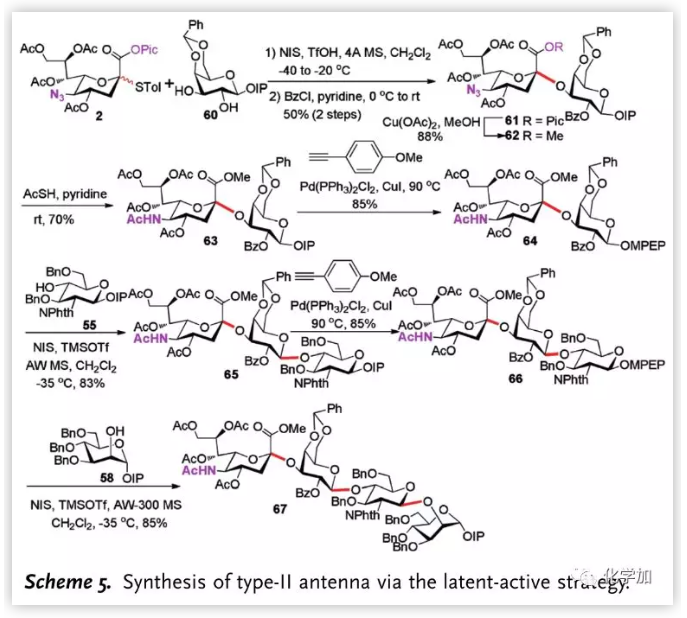
圖片來源:Angew. Chem. Int. Ed.
為明確反應機理,查明該糖苷化反應的立體選擇性來源,作者比較了1-位Pic給體和OMe給體與不同受體反應的立體選擇性(Table 5.),發現OMe給體反應的立體選擇性較Pic給體有了極大下降,表明Pic對立體選擇性有指導作用。

圖片來源:Angew. Chem. Int. Ed.
因此,作者提出三種可能的反應機理(Figure 1.)。2被活化后,氧鎓離子在a途徑中與Pic酯直接通過鄰基參與生成II,隨后與受體發生SN2反應得到糖苷化產物;b途徑中,硫苷被活化離去后,Pic迅速質子化生成III,III與HOTf反應生成β-OTf酯IV,發生SN2反應生成產物;c途徑中,氧鎓離子率先接受Pic基團進攻生成II及II′,隨后在當量的HOTf作用下生成OTf酯中間體接受親核進攻以SN2(類SN2)機理生成α-糖苷鍵。
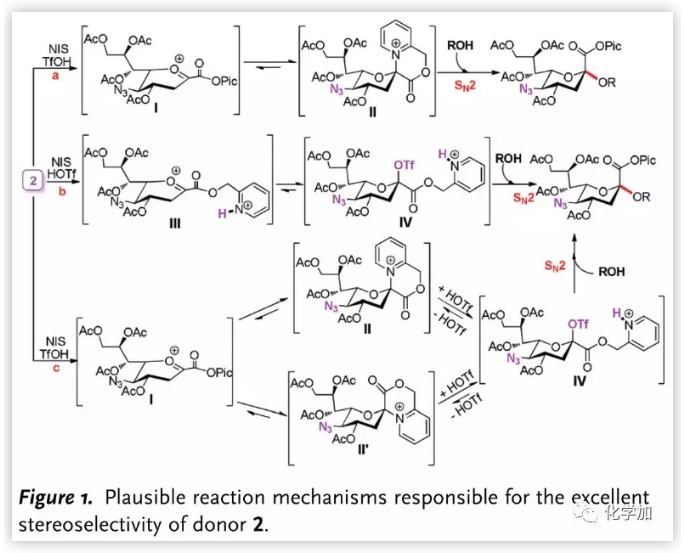
圖片來源:Angew. Chem. Int. Ed.
作者接著進行了詳細的對比實驗(Table 6.)。其通過entry1-3的結果排除了途徑a;entry 4-7證明反應的α選擇性隨1-位保護基吸電子能力提升;隨后作者通過試劑反加策略證明途徑b不適用于β-硫苷的活化,因此途徑c是最有可能的反應路徑,作者也通過entry 15-17驗證了他們提出的假說。在路徑c中,中間體IV可能以緊密離子對形式存在,因此無法通過低溫核磁直接觀察其結構。
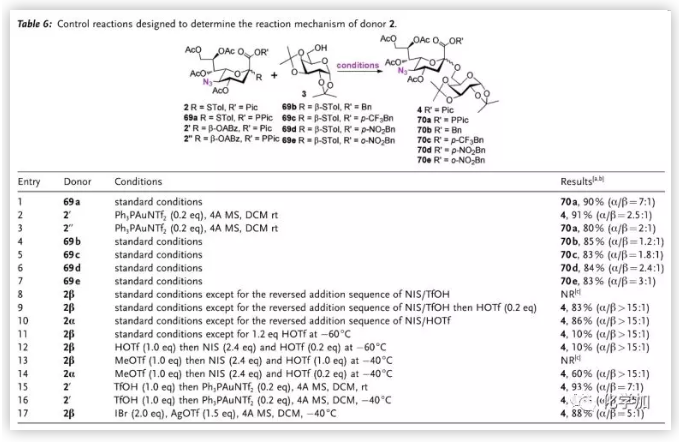
圖片來源:Angew. Chem. Int. Ed.
作者也通過DFT計算驗證了反應機理(Figure 2.)。其中,IVβ′能量比IIα′及IIβ′低,證明II向IV的轉化是熱力學有利的;同時,IVβ′比IVα′要穩定,證明了IVβ′是反應的關鍵中間體,其通過SN2反應生成α-糖苷鍵。
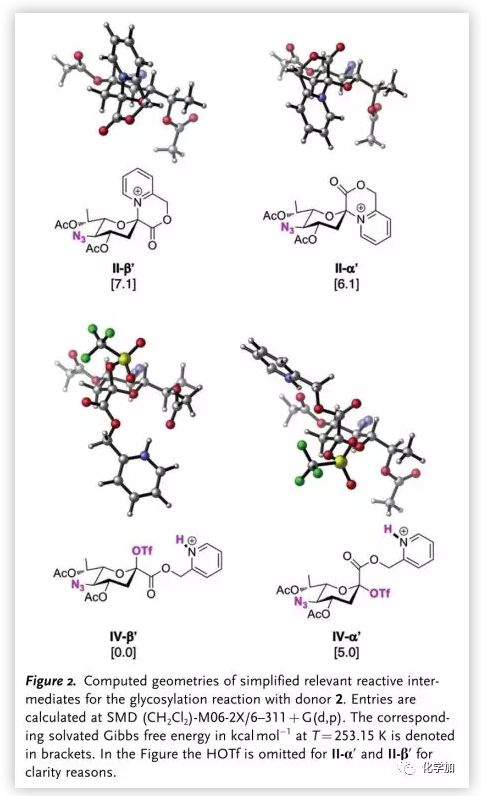
圖片來源:Angew. Chem. Int. Ed.
最后,作者通過室溫的糖苷化反應和克級反應說明該反應可以滿足科研需要(Scheme 6.)。
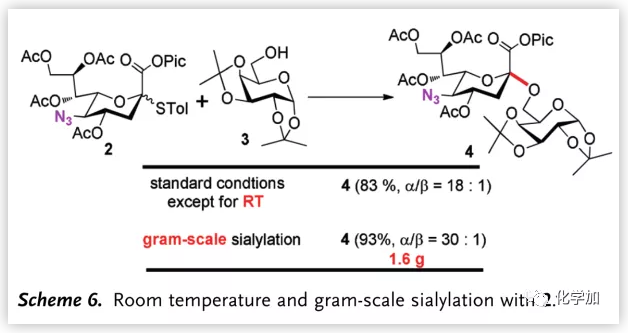
圖片來源:Angew. Chem. Int. Ed.
撰稿人:H.D.
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn