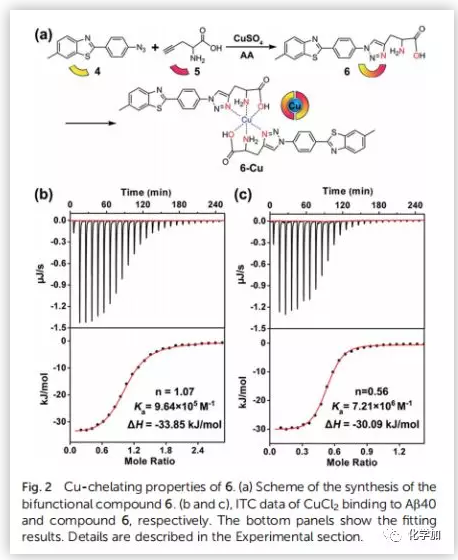
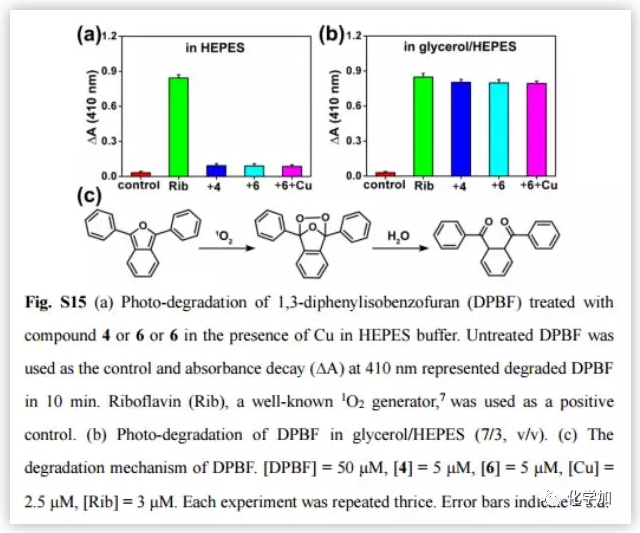
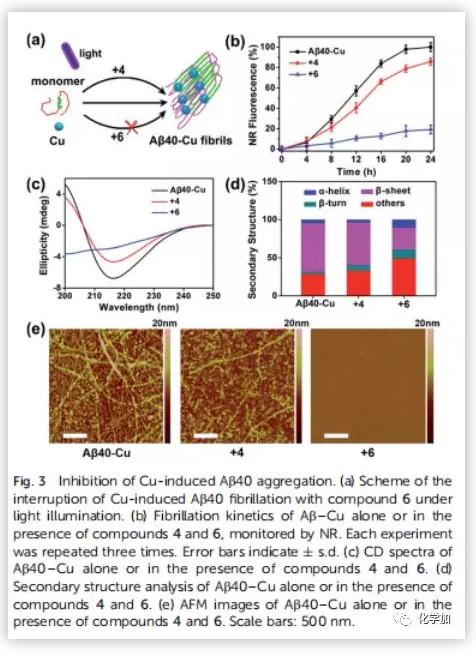
阿爾茨海默病(AD)影響著全球約5000萬人,大量研究證明AD與β-淀粉蛋白(Aβ)聚集和銅離子濃度失調(diào)密切相關(guān)。正常大腦中的銅含量為0.2-1.7 uM,而Aβ斑塊中銅的濃度可達(dá)0.4 mM。銅是生命不可或缺的元素之一,銅濃度的波動(dòng)與多種疾病有關(guān),包括門克斯病、威爾遜病等遺傳病;阿爾茨海默病、帕金森病、亨廷頓病、朊病毒病等神經(jīng)退行性疾病。對于與銅積累引起的疾病,最常見的治療策略是直接使用銅螯合劑。然而,由于螯合劑的無特異性可能會引起很多副作用。近日,曲曉剛研究員課題組設(shè)計(jì)用Aβ特異性光敏劑4與Cu預(yù)螯合劑5合成雙功能化合物6(Fig.2a),是一種很有吸引力的AD治療藥物。光氧化Aβ可以通過增強(qiáng)蛋白極性分解Aβ聚集物,而銅離子可以協(xié)調(diào)促進(jìn)Aβ聚合。因此,由銅積累的β-淀粉蛋白(Aβ)斑塊(Aβ-Cu聚集體)催化疊氮-炔烴生物正交環(huán)加成反應(yīng)(CuAAC),原位合成具有光氧化Aβ和螯合Cu特性的藥物就能有效地體內(nèi)分解Aβ-Cu聚集體。作者采用光譜滴定法和等溫滴定量熱法(ITC)測定了化合物6與銅的結(jié)合度(n)和結(jié)合親和力。在ITC測定中,銅與Aβ40和化合物6表觀結(jié)合常數(shù)(K)分別為9.64 x 105 M-1和7.21 x 106 M-1(Fig.2b and 2c)。化合物6與銅的親和度適宜于破壞Aβ40-Cu相互作用,而不影響酶的正常功能。作者評估了化合物6對Aβ的光氧化能力。采用1,3-二苯異苯并呋喃(DPBF)檢測光激發(fā)化合物6生成的單線態(tài)氧(1O2)。利用甘油增加溶液粘度,限制化合物6的鍵旋轉(zhuǎn)。與(HEPES)緩沖液作對照,化合物6在甘油/HEPES混合溶液中產(chǎn)生更多的1O2(Fig.S15)。Aβ40的MS峰為4330,光氧化Aβ40的MS峰為4346、4362、4378、4394、4410,證實(shí)了化合物6可以有效地光氧化Aβ40(Fig.S16)。探究化合物6對Cu加速Aβ40聚集反應(yīng)的抑制作用。用尼羅紅(NR)檢測Aβ40單體(10 μM)和Cu (10 μM)單獨(dú)存在,和與化合物4和6共同存在時(shí)的纖維震顫。圓二色性(CD)、AFM檢測Aβ40的聚集情況。隨著潛伏期的延長,Cu誘導(dǎo)Aβ40形成大量β層狀折疊的纖維,化合物6阻斷了這一過程。然而,由于缺乏螯合Cu的部分,化合物4不能抑制Cu誘導(dǎo)的Aβ40聚集(Fig.3)。
(圖片來源:Chem. Sci.)
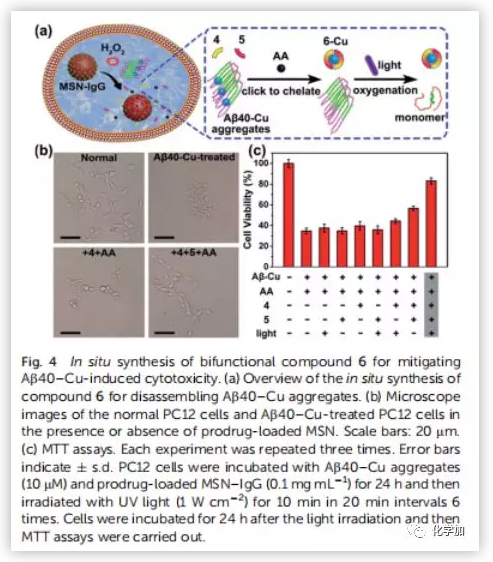
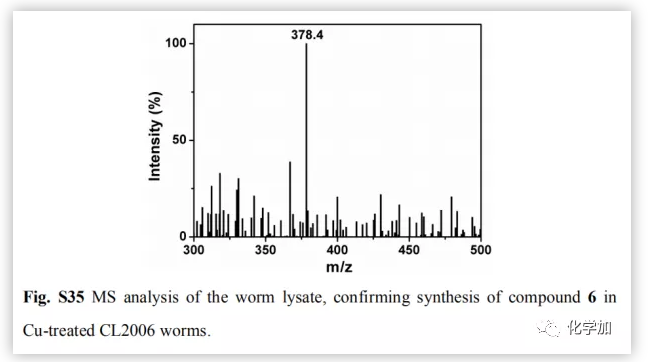
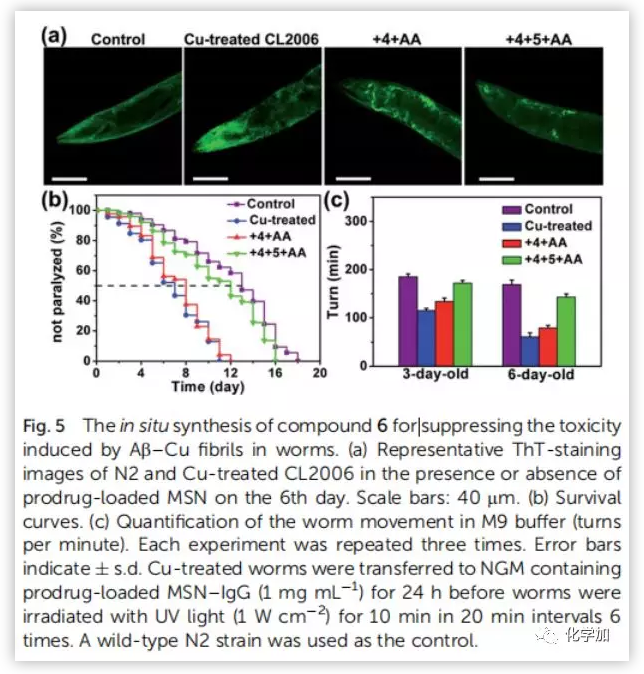
為了評價(jià)原位合成藥物6在細(xì)胞中的治療潛力,將PC12細(xì)胞與Aβ40-Cu聚集物和前藥負(fù)載的MSN-IgG9(對Aβ40-Cu催化產(chǎn)生的H2O2敏感)共同孵育。前藥(4,5和AA)在細(xì)胞中釋放(Fig.4a)。然后Aβ40-Cu聚合物催化CuAAC反應(yīng),原位合成化合物6。此外,化合物6的產(chǎn)量隨著Aβ-Cu濃度的增加而增加。因此,在不使用外源性銅催化劑的情況下,原位藥物合成可以通過細(xì)胞中Aβ40-Cu聚集物的水平自我觸發(fā)和調(diào)節(jié)。Aβ40-Cu聚合物破壞了細(xì)胞形態(tài),導(dǎo)致細(xì)胞死亡。相比之下,原位合成藥物6使PC12細(xì)胞恢復(fù)正常形態(tài),使細(xì)胞存活率從37%提高到82%。然而,化合物4沒有表現(xiàn)出類似的保護(hù)作用(Fig.4b and 4c)。結(jié)果表明,化合物6 通過螯合銅和光氧化Aβ,抑制Aβ40-Cu聚集物所引起的細(xì)胞毒性。然后,作者探討了化合物6的原位合成是否能抑制Aβ40-Cu聚集物引起AD模型秀麗線蟲CL2006的麻痹。MS證實(shí)經(jīng)過Cu處理的CL2006中合成了化合物6(Fig.S35)。生長曲線證明,Aβ40-Cu聚合體可誘導(dǎo)AD模型CL2006株麻痹,縮短其壽命,并導(dǎo)致行為缺陷,而原位合成的化合物6可減少Aβ40-Cu聚集物,抑制CL2006麻痹,提高其活動(dòng)力(Fig.5b)。
總結(jié):曲曉剛研究員課題組設(shè)計(jì)原位合成的雙功能藥物,具有光氧化Aβ和螯合Cu特性,能有效地體內(nèi)分解Aβ-Cu聚集體。由銅積累的β-淀粉蛋白(Aβ)斑塊催化疊氮-炔烴生物正交環(huán)加成反應(yīng)(CuAAC),激活熒光團(tuán)并進(jìn)行藥物合成,可以實(shí)現(xiàn)AD治療的自觸發(fā)和自調(diào)節(jié)。在活細(xì)胞、轉(zhuǎn)基因AD模型秀麗線蟲CL2006以及三轉(zhuǎn)基因AD小鼠的大腦切片中都有效果。作者的研究為利用內(nèi)源性神經(jīng)毒性金屬離子原位合成治療神經(jīng)退行性疾病的多功能藥物開辟了新的途徑。