在有機化學(xué)領(lǐng)域,羰基化合物常常作為關(guān)鍵的合成子合成具有復(fù)雜結(jié)構(gòu)的分子。羰基化合物參與的反應(yīng)類型如:Grignard反應(yīng)、Wittig反應(yīng)、還原胺化反應(yīng)等均是將羰基化合物作為碳正離子等價體的反應(yīng)。通過極性反轉(zhuǎn)的方式也可以實現(xiàn)羰基化合物作為碳負離子等價體的反應(yīng)。但羰基化合物脫氧作為烷基自由基等價體的反應(yīng)卻從未實現(xiàn)(圖1A)。因此,將羰基化合物作為親核性的烷基自由基來參與有機化學(xué)反應(yīng)無疑將豐富羰基化合物的反應(yīng)性,使得其在合成中的應(yīng)用更加廣泛。生物體中進行著各種各樣的自由基反應(yīng),其中質(zhì)子遷移電子耦合(PCET)是生物體中一種非常重要的活化醛和酮的過程。最近,Knowles課題組報道了一系列光催化的PCET過程實現(xiàn)醛和酮向羰游基的轉(zhuǎn)化(圖1B)。脫氧核糖作為DNA的合成單元,是由核糖通過自由基脫氧過程合成的。該過程的關(guān)鍵一步在于羰游基發(fā)生自旋中心遷移(SCS)脫去一分子水得到脫羥基的產(chǎn)物(圖1C)。南開大學(xué)汪清民教授課題組在Minisci反應(yīng)方面做了一系列開創(chuàng)性的工作(Sci. Adv. 2019, 5: eaax9955;Chem. Sci. 2019, 10, 976; Org. Lett. 2019, 21: 5728; Org. Lett. 2018, 20, 5661; Org. Chem. Front. 2019, 6, 2902; J. Org. Chem. 2019, 84, 7532.)。考慮到光催化條件下的PCET過程和生物體中進行的SCS過程的高效性,南開大學(xué)汪清民教授課題組將光催化條件下的質(zhì)子遷移電子耦合(PCET)過程和生物體中進行的自旋中心遷移(SCS)過程結(jié)合起來,通過PCET過程活化羰基得到羰游基,羰游基對氮雜芳環(huán)加成后再通過SCS過程斷裂C-O鍵來實現(xiàn)羰基化合物脫氧的Minisci反應(yīng)(圖1D)。
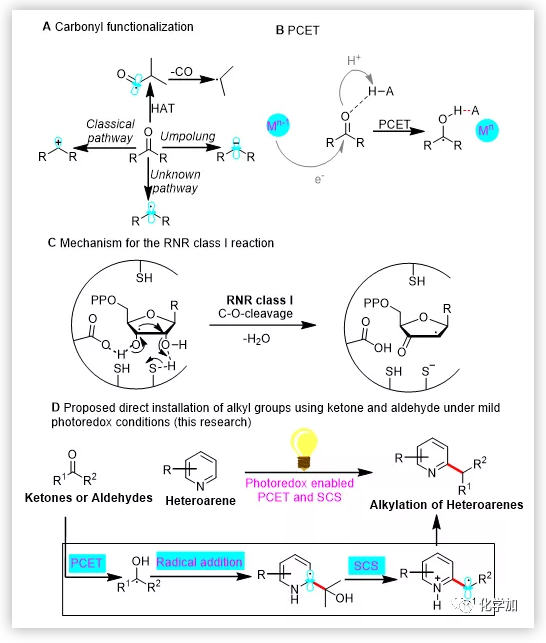
圖1 羰基化合物脫氧的Minisci反應(yīng)
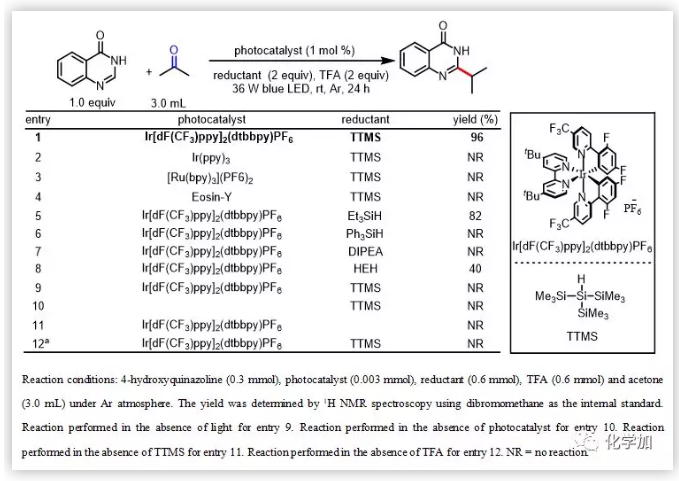
作者以4-羥基喹唑啉和丙酮(溶劑)作為反應(yīng)底物,篩選了多種光催化劑和還原劑。當(dāng)使用Ir[dF(CF3)ppy]2(dtbbpy)PF6(1 mol%)作為光催化劑,三-(三甲基硅基)硅烷(TTMS 2.0 equiv)作為還原劑,TFA作為質(zhì)子源時反應(yīng)能以96%的核磁收率得到目標產(chǎn)物12。隨后作者以環(huán)己酮為烷基化試劑對反應(yīng)溶劑進行篩選,得到乙腈是最優(yōu)的反應(yīng)溶劑。作者進一步做了控制實驗,該反應(yīng)在沒有光照、沒用光催化劑、沒有酸以及沒有還原劑的條件下均不能發(fā)生。值得注意的是,反應(yīng)使用TTMS作為還原劑是非常重要的,因為常用的胺類還原劑會與TFA形成鹽,HEH還原劑會將氮雜環(huán)給還原得到氫化的產(chǎn)物(表1)。
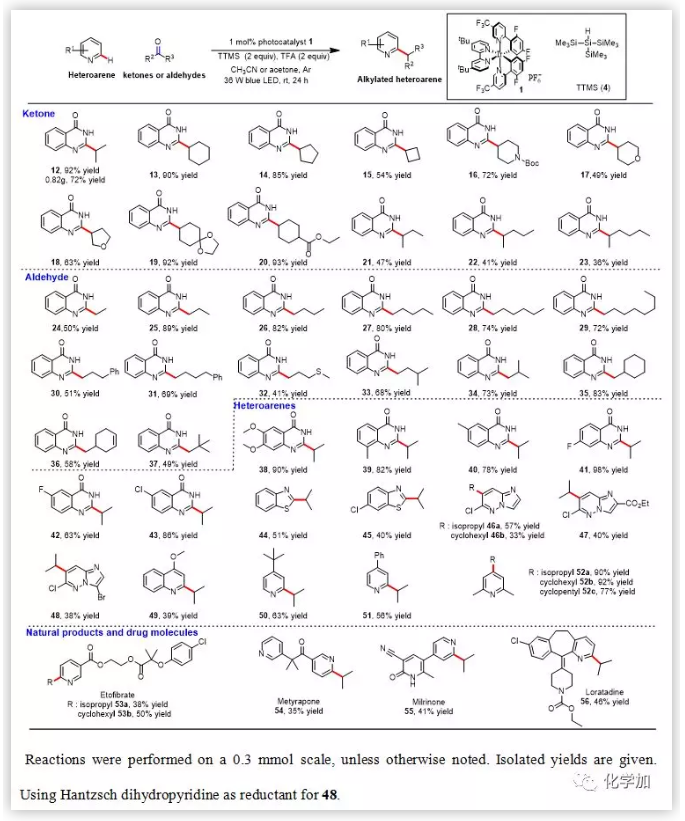
得到最優(yōu)的反應(yīng)條件后,作者首先對酮和醛的底物范圍進行考察,作者發(fā)現(xiàn)該反應(yīng)對于酮和醛的適用范圍較廣且以中等到良好的收率得到目標產(chǎn)物(表2)。環(huán)狀和鏈狀的酮均能以中等到良好的收率得到目標產(chǎn)物(12-23),但是對于鏈狀酮來說,隨著碳鏈長度的增加,反應(yīng)的產(chǎn)率逐漸降低。作者推測隨著碳鏈長度的增加,生成的羰游基的位阻逐漸增加,這使得羰游基對氮雜芳環(huán)的親核加成能力逐漸下降。該反應(yīng)對于多種多樣的醛也同樣適用(24-37),而且鏈狀醛的產(chǎn)率比鏈狀酮要高,這是由于由醛形成的羰游基(二級碳)比酮形成的羰游基(三級碳)位阻要小。隨后作者對氮雜芳環(huán)的底物適用范圍進行考察,該反應(yīng)對于氮雜芳環(huán)的適用范圍較廣且以中等到良好的收率得到目標產(chǎn)物,反應(yīng)發(fā)生在氮雜芳環(huán)上最缺電子的位置(表2)。作者首先對4-羥基喹唑啉類底物進行考察,無論是吸電子基取代還是供電子基取代的4-羥基喹唑啉均能夠以較好的收率得到目標產(chǎn)物(38-43)。一些常見的氮雜芳環(huán)如苯并噻唑、噠嗪、4-甲氧基喹啉等也能以中等的收率得到目標產(chǎn)物(44-49)。吡啶類底物同樣也能適用于該反應(yīng),4-苯基和叔丁基吡啶能以中等的收率得到C2位單烷基化的產(chǎn)物(50, 51)。這是因為單烷基化的產(chǎn)物50和51由于親電性降低,很難進行雙烷基化反應(yīng)。2,6-二甲基吡啶能以良好的收率得到C4位烷基化的目標產(chǎn)物(52)。在藥物分子中引入小的官能團(甲基、乙基、異丙基、叔丁基等)對于藥物化學(xué)家研究這類藥物的性質(zhì)具有重要的意義。為了展示這種方法的實用性,作者用該方法對一些常見的藥物和天然產(chǎn)物進行后期官能團化研究(表2)。例如,乙托貝特能夠以中等的收率得到得到吡啶環(huán)烷基化的產(chǎn)物53。甲吡酮是皮質(zhì)醇生物合成的抑制劑,能夠以35%的收率選擇性得到單烷基化的產(chǎn)物54。米力農(nóng)是磷酸二酯酶3的抑制劑和血管舒張劑,能夠以41%的收率得到烷基化產(chǎn)物55。抗組胺藥氯雷他定可在吡啶環(huán)C2位選擇性烷基化得到56。
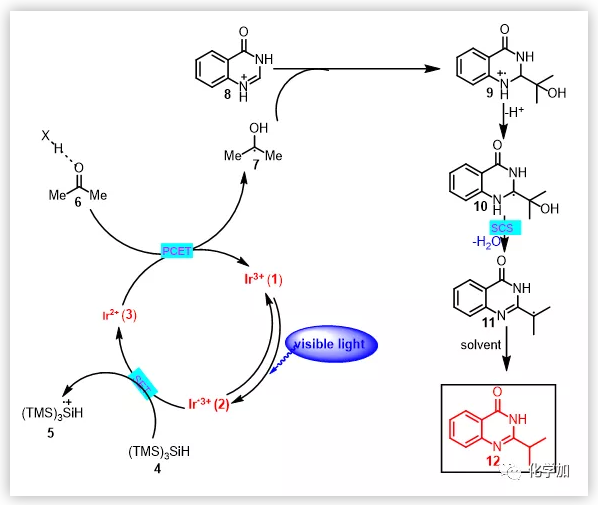
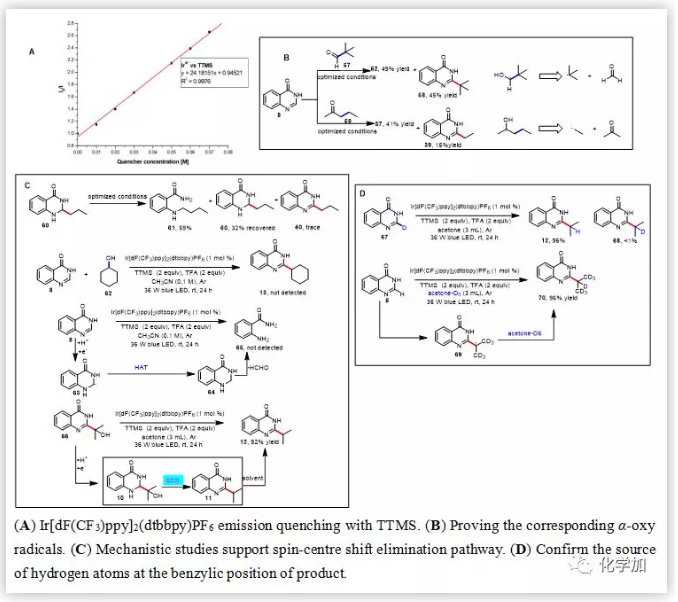
在探索了反應(yīng)的底物適用范圍和反應(yīng)的應(yīng)用性后,作者對反應(yīng)的機理進行研究(圖2)。從文獻中查得TTMS的氧化電勢為0.71V,而光催化劑Ir[dF(CF3)ppy]2(dtbbpy)PF6的氧化電位位1.21V,這說明三價的光催化劑Ir*3+能夠?qū)?/span>TTMS氧化成TTMS+?,同時得到強還原性的二價態(tài)光催化劑。猝滅實驗證明了TTMS能夠?qū)⒐獯呋瘎┾?/span>(圖 2A)。當(dāng)以57為烷基化試劑時,能夠以45%的收率得到叔丁基加成的產(chǎn)物58,這表明相應(yīng)的羰游基通過α裂解得到叔丁基自由基(圖 2B)。當(dāng)以59為烷基化試劑,能夠以16%的收率得到乙基自由基加成的產(chǎn)物39, 這表明相應(yīng)的羰游基通過β裂解得到乙基自由基(圖 2B)。在模板反應(yīng)條件下,以60作為反應(yīng)底物僅僅得到微量的產(chǎn)物40,這說明60不是反應(yīng)中間體(圖 2C)。在模板反應(yīng)條件下,以62作為反應(yīng)底物沒有檢測到產(chǎn)物13生成,這說明62不是反應(yīng)中間體(圖 2C)。在模板反應(yīng)條件下,不加羰基化合物,沒有檢測到65的生成,這說明光催化劑不能將8還原(圖 2C)。在模板反應(yīng)條件下,以66作為反應(yīng)底物,能夠以92%的收率得到產(chǎn)物12,這說明64是反應(yīng)中間體。作者推測64被光催化劑還原得到中間體10,中間體10發(fā)生SCS脫去一分子水得到脫羥基的中間體11,11從溶劑中攫取一個氫原子得到最終產(chǎn)物12(圖2C)。當(dāng)用氘代丙酮作為反應(yīng)溶劑時,以96%的收率得到芐位上氘的產(chǎn)物,這說明11從溶劑丙酮中攫取一個氫原子得到最終產(chǎn)物12(圖 2D)。
基于機理實驗和相關(guān)文獻報道,作者提出了如下的反應(yīng)機理(圖3)。在光照條件下,光催化劑被激發(fā),激發(fā)態(tài)的三價光催化劑將三-(三甲基硅基)硅烷(TTMS)氧化成TTMS+?,同時得到強還原性的二價態(tài)光催化劑。在酸性條件下,二價態(tài)的光催化劑與羰基化合物6發(fā)生PCET過程完成整個光催化的循環(huán),同時得到羰游基7,親核性的羰游基7對氮雜芳環(huán)加成得到反應(yīng)中間體9。反應(yīng)中間體9的氮α位脫去質(zhì)子得到中間體10,中間體10發(fā)生SCS脫去一分子水得到脫羥基的中間體11。11從溶劑中攫取一個氫原子得到最終產(chǎn)物12。總結(jié):汪清民教授課題組將光催化條件下的質(zhì)子遷移電子耦合(PCET)過程和生物體中進行的自旋中心遷移(SCS)過程結(jié)合起來,通過PCET過程活化羰基得到羰游基,羰游基對氮雜芳環(huán)加成后再通過SCS過程斷裂C-O鍵來實現(xiàn)羰基化合物脫氧的Minisci反應(yīng)。高的反應(yīng)效率、溫和的反應(yīng)條件、廣泛的底物適用范圍和良好的官能團兼容性使得該反應(yīng)特別適用于對復(fù)雜的含氮藥物和天然產(chǎn)物進行后期官能團化修飾。這也是首例將羰基化合物作為烷基自由基等價體的反應(yīng)。本篇工作通訊作者為南開大學(xué)的汪清民教授。南開大學(xué)博士研究生董建洋為該論文的第一作者,南開大學(xué)副研究員劉玉秀、講師宋紅健、碩士研究生王振和王皛琛對該工作的順利進行也做出了重要貢獻。上述研究工作得到了國家自然科學(xué)基金重點項目(21732002) 和南開大學(xué)化學(xué)學(xué)院博士生科研創(chuàng)新計劃項目的資助。 文章鏈接:https://advances.sciencemag.org/content/5/10/eaax9955