

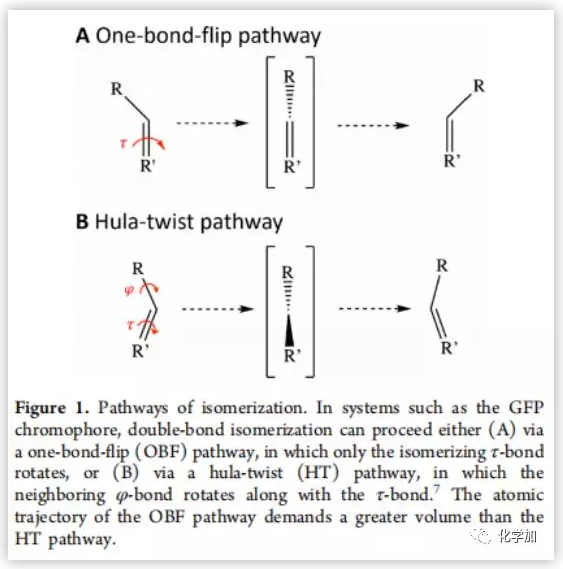
光異構化反應由于其靈敏的感光生物學功能,被廣泛的應用于化工領域,如光學數據儲存、分子轉換。光異構反應中,以雙鍵順反異構化最為常見。共軛體系如綠色熒光蛋白(GFP)雙鍵的異構化有兩種途徑,單鍵翻轉(OBF)和鍵角扭轉(HT)(Figure 1)。OBF途徑只有τ鍵旋轉,而HT途徑相鄰的φ鍵隨著τ鍵旋轉,OBF途徑的原子軌道所需要的體積比HT途徑大。因此,OBF途徑常發生在允許自由運動的環境中,而HT途徑常發生在空間受限的環境中。
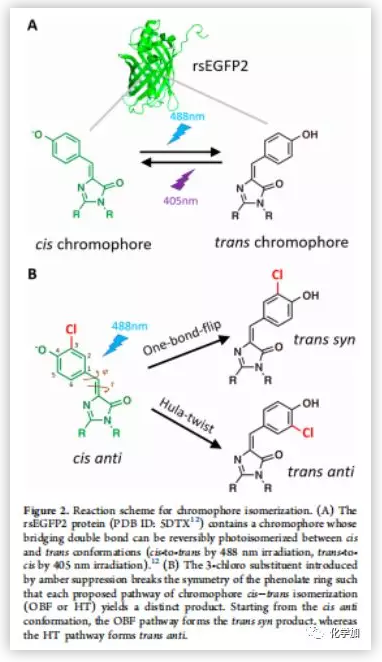
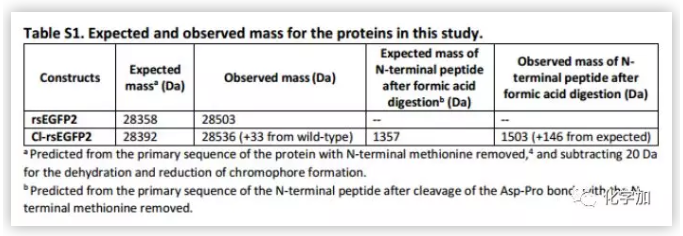
為了探尋綠色熒光蛋白(GFP)雙鍵光學異構化的途徑,作者以rsEGFP2(可逆轉換增強綠色熒光蛋白2) 為模型進行檢測。rsEGFP2具有易結晶的特點和良好的光學特性。β-桶狀折疊的rsEGFP2發光團自然條件下呈現順式構象,在488nm的激光照射下很容易異構化為反式構象,相反,在405nm的激光照射下,反式構象異構化回順式構象。rsEGFP2還有一個顯著的優點,rsEGFP2很容易被基團取代用來區分OBF和HT途徑。在野生型細胞中,rsEGFP2通過兩種途徑產生相同的反式產物。但如果取代基破壞rsEGFP2酚環的對稱性,兩種途徑就會產生不同的產物。當帶有取代基的cis rsEGFP2發生OBF途徑時,變為trans syn,發生HT途徑時,變為trans anti(Figure 2B)。通過琥珀抑制使3-氯酪氨酸替換67殘基處的酪氨酸,生成一個鄰位氯取代的酚氧色團。此變體Cl-rsEGFP2與野生型rsEGFP2有類似的光敏特性(Table S1)。
(圖片來源:J. Am. Chem. Soc.)
(圖片來源:J. Am. Chem. Soc.)
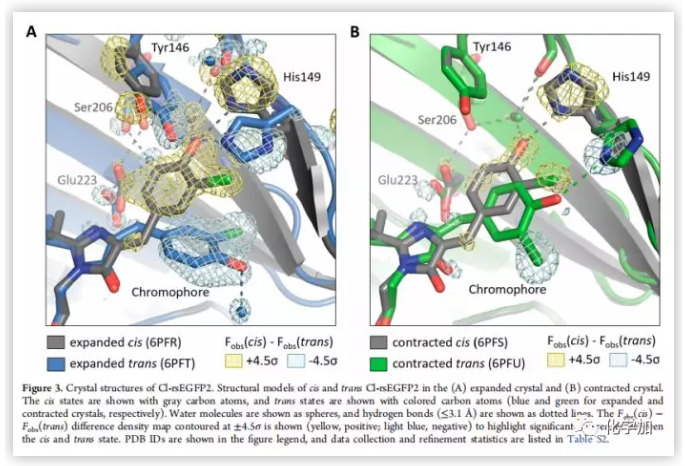
以發光團cis狀態為準,氯取代基處于anti的方向(Figure 3A)。當發光團異構化為trans,氯取代基處于syn的方向,并且Cl-rsEGFP2的兩個環不再平行(τ = 12°, φ = ?13° in cis; τ = 187°, φ = ?32° in trans τ 為N?C=C?C1二面角,φ 為 C=C?C1?C6二面角)(Figure 2B),另外,空間構象輕微扭曲形成新的反式構象,酚羥基不再與His149形成氫鍵,而與水分子形成氫鍵。His149與Tyr146形成氫鍵(Figure 3A)。
作者統計比較了一些Cl-rsEGFP2的晶體數據,發現一些晶體的單位尺寸大小比之前報道的小7%,眾所周知,當水進入或離開單個蛋白質之間的溶劑通道時,蛋白質晶體會膨脹或收縮。實驗操作的微小變化會導致Cl-rsEGFP2的溶劑含量變化。作者發現可通過將Cl-rsEGFP2晶體浸泡在相對濕度較低的低溫保護劑中,來控制降低Cl-rsEGFP2的晶格間距。低溫保護劑可將水從晶體中抽出,使之更緊密聚集在一起,從而得到“收縮”晶體。當Cl-rsEGFP2收縮成更緊密的晶格時,其折疊方式不變,但尾部和環路區域出現了輕微偏差。蛋白質在cis狀態下收縮晶體與膨脹晶體的內部幾何構型相同,trans狀態下收縮晶體與膨脹晶體相比空間結構明顯扭曲。有趣的是,trans狀態下收縮晶體Cl-rsEGFP2的兩個環平行,且與與His149形成氫鍵(Figure 3B)。這種現象在多個晶體中都有發現。Cl-rsEGFP2的晶體結構表明,晶格的微小重排可以改變光異構化途徑。由于順反異構化反應對介質的空間結構很敏感,膨脹晶體常以OBF途徑異構,而收縮晶體則以HT途徑異構。
(圖片來源:J. Am. Chem. Soc.)
Kao等人以Dronpa(可逆光致變色熒光蛋白)為研究對象,觀察到介質粘度增加會減慢Dronpa的光敏速率,無論是溶劑粘度還是晶體填料都會影響發光團異構化,表明發光團的異構化與蛋白質的β-桶狀折疊運動是耦合的。本文作者研究結論與其相似。Cl-rsEGFP2的結晶條件可能會干擾蛋白質的結構并引起功能后果。眾所周知,蛋白質的向外殘基和柔性環在晶體內可能相互作用引起結構改變,而蛋白質內部很少受到影響。而本文中,trans Cl-rsEGFP2的晶體結構單位體積收縮7%時,出現了明顯的結構改變,說明晶體填充的相互作用影響了trans Cl-rsEGFP2內殘基的構象。
小結:本文詳述了Cl-rsEGFP2晶體順反異構化的機理。顯然,蛋白質異構化的途徑不是蛋白質所固有的,而是取決于蛋白質在晶體中的構象。膨脹晶體常以OBF途徑異構化;單位體積收縮7%的收縮晶體常以HT途徑異構化。研究發現發光團的異構化與蛋白質的β-桶狀折疊運動是耦合的。在不同的熒光蛋白中,異構化的機制可能不一樣。研究結果表明結晶條件可能會導致蛋白質面向內的殘基結構重排。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn