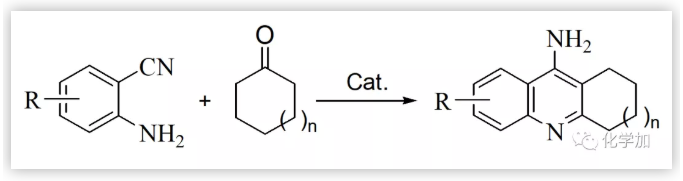
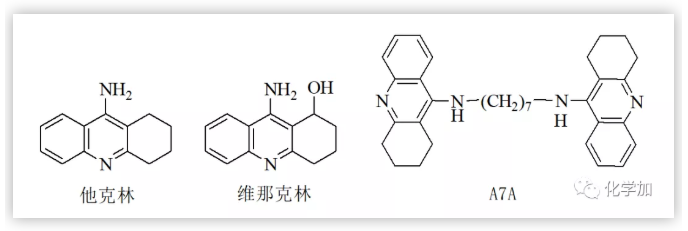
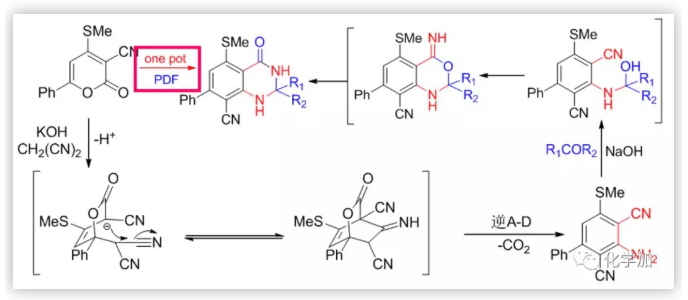
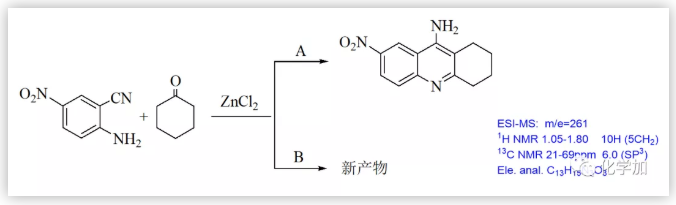
Friedl?nder反應是眾多的有機人名反應中比較重要的反應之一,該反應發現至今已有100多年的歷史,目前仍然是人們關注和研究的重點之一,每年還有大量涉及該反應的文獻報道。在不同類型的Friedl?nder反應中,鄰氨基芳香腈與環(已)酮反應制得吖啶及其類似物的反應格外引人注目(Scheme 1)。這類化合物的典型代表是經由鄰氨基苯甲腈與環己酮縮合所制得的9-氨基-1,2,3,4-四氫吖啶(他克林,Tacrine, THA),該化合物早在1906年就已由德國學者合成出來,但其應用一直沒有得到開發。上世紀八十年代,英美科學家研究發現,該化合物具有延緩Alzheimer癥的功能;1993年成為美國FDA批準上市的第一個用于治療老年癡呆的乙酰膽堿酯酶抑制劑,至今仍然是臨床應用的藥物之一。但該藥存在肝毒性較大、日服用次數多、服用劑量大等不足,影響了其使用,因此人們對其做了大量的結構修飾,合成了一系列他克林衍生物及其類似物,取得了一些進展,如毒副作用較低的維那克林,綜合性能較好的A7A等。在進行他克林結構修飾物研究中,當我們用5-硝基-2-氨基苯甲腈代替鄰氨基苯甲氰與環己酮反應,除了得到預期的目標物——7-硝基他克林外,還得到一種淺黃色的固體(Scheme 2)。
Scheme2
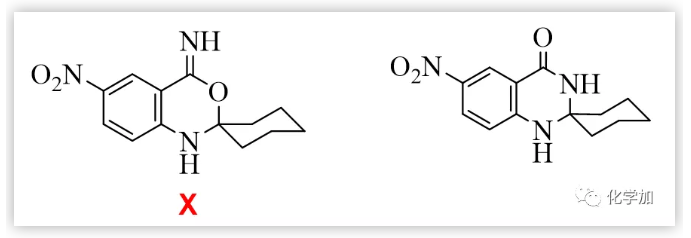
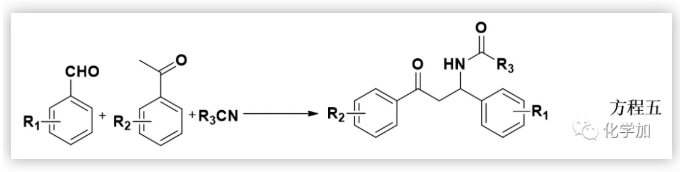
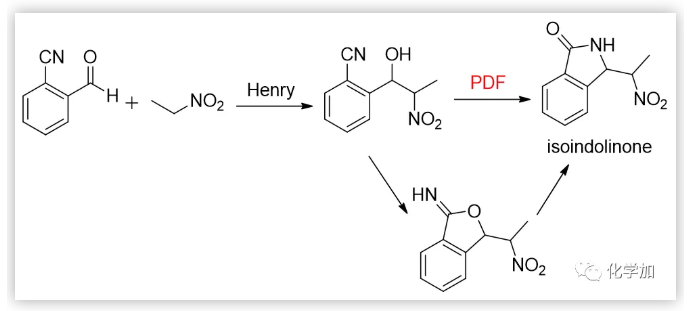
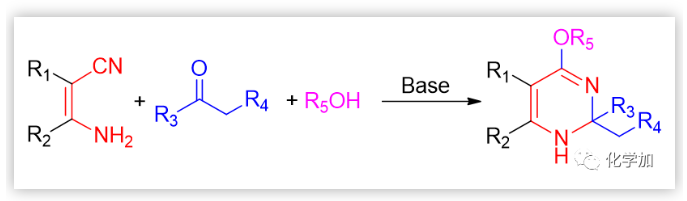
該固體的元素分析表明它可能是預期的7-硝基他克林的單水合物;但紅外、核磁和質樸表征表明它的結構不可能是7-硝基他克林,因為在1H NMR中,化學位移于1.05-1.80處存在10個(不是8個)亞甲基質子吸收峰;在13C NMR中,化學位移112-162ppm處存在7個(不是9個)SP2雜化的碳原子吸收峰,化學位移21-69ppm 處存在6個(不是4個)SP3 雜化碳原子吸收峰;ESI質譜給出的分子離子峰為261(不是243)。這都表明得到的化合物不可能是預期的7-硝基他克林,只可能是新的化合物(4H-3,1-苯并噁嗪或二氫喹唑啉酮)。早期,我們認為這種新轉換產物的結構是4H-3,1-苯并噁嗪衍生物,這個結論也在隨后獲得馬德里大學的Contelles教授課題組的確認(J. Chem. Res., 2008,(8), 536-536).隨后,我們意識到,新轉化產物的結構更可能是二氫喹唑啉酮骨架物。這里,4H-3,1-苯并噁嗪和二氫喹唑啉酮骨架的差別十分細微,很難區別。通過大量細致的波譜表征、單晶測定、驗證實驗和理論計算等表明新轉化產物的結構是二氫喹唑啉酮。這里,德國Rostock大學的Peter Langer和浙江科技大學的吳曉峰合作用二維核磁測定并分析了遠程質子想和作用,為開展喹唑啉酮骨架結構的確定起到了重要作用(RSC Adv., 2014, 4, 8–17)系統研究表明:新轉化具有很好的普適性,新舊轉化可能同時存在,關鍵是羥胺中間體是否脫水:若脫水則按Friedl?nder反應途徑進行;不失水,則按新轉化機理進行(Scheme 3):PDF轉化的命名 由于這是在進行Friedl?nder反應研究中發現的由分子內的Pinner縮合到Dimroth重排而生成喹唑啉骨架物的轉化,因此我們取這三個人名反應的首字母組成而命名為PDF轉化(Synlett. 2008. (2), 233-236)。PDF轉化機理獲得了一系列證據的證實,特別是東北師范大學張景萍教授的工作從理論上對PDF轉化機理提供了幫助(J. Computational Chem., 2015, 36, 1295-1303)。由于這類底物在進行Friedl?nder反應和PDF轉化中都經過羥胺關鍵中間體,故此這類底物的反應是一類新型分岔反應,其顯著特征是:分岔產物不是結構類似物,也不是同分異構體(這兩點是一般文獻報道的分岔反應的主要特征),而是兩類結構迥異的骨架產物。毫無疑問,這兩種轉化的含氮雜環化合物都十分重要,在天然產物、醫藥、材料等領域廣泛存在。如能實施可控的單一轉化則無需分離,其效率和環境價值一目了然。系統的研究表明:酸性(部分中性、加熱)條件下則為Friedl?nder產物,堿性條件下則幾乎都為PDF轉化產物。有意思的是,文獻關于這類底物的Friedl?nder反應恰恰以酸性條件催化為主,幾乎不見堿性條件下的轉化,這也說明了為什么這類反應雖為世人認知百年而未能發現PDF轉化的原因。底物拓展研究表明:可控的PDF轉化具有非常好的底物普適性,可以便捷地利用可控PDF轉化合成一系列含有嘧啶酮骨架的含氮雜環化合物。堿、有機胺、微波、離子液體、卡賓等都可以實施或促進PDF轉化的進行。至此,可以清楚地認知此類反應的全貌:即Friedl?nder反應僅是此類反應的一半內容,而另一半PDF轉化一直深藏未露。很顯然,如果PDF轉化僅僅局限在鄰氨基腈與羰基化合物的轉化上,由于底物的局限性,這個反應的應用將十分局促。當我們把思路打開,研究表明氨基、腈基、不飽和羰基化合物等三官能團雙分子的隨意組合都能進行PDF轉化。此外,鄰氨基酸/酯與羰基化合物、鄰羥基腈與羰基化合物及其相關的組合都可以進行PDF轉化。 上面均是三官能團雙分子之間的PDF轉化,更可喜的是,三官能團三分子之間的PDF轉化(方程五)也可以實現:我們把諸多可以生成鄰氨基腈的反應與PDF轉化進行組合,實施了一系列含有PDF轉化的構建多氮稠合雜環化合物的轉化。比如我們組合東北師大劉群教授駕輕就熟的烯二硫醚與印度多個課題組采用的吡喃酮與丙二睛的轉化,可以由一鍋吡喃酮與丙二睛、羰基化合物多步一鍋轉化得到多取代喹唑啉酮(Scheme 4)。這個反應的完整轉化過程至少包含了親核、環縮合、逆D-A、分子內的Pinner、Dimroth重排(PDF轉化)等近十步連續轉化,非常高效和有趣!而瑞典Olof Ramstrom教授等則組合Henry反應與PDF轉化,利用鄰腈基芳香醛與硝基烷烴反應,一鍋制備了異吲哚酮(Scheme 5)(J. Org. Chem., 2008, 73: 2582;Chem. Commun., 2008,768-770).當我們用鄰氨基腈、羰基化合物在醇溶液中進行PDF轉化研究時發現,醇可以參與底物的PDF轉化,從而得到鄰氨基腈、羰基化合物和醇三組分一鍋縮合生成4-烷氧基取代的喹唑啉衍生物(Scheme 6)。七、首次在同一底物的反應中,既得到了Friedl?nder和PDF轉化產物,還得到了交叉縮合的產物當我們用對稱的鄰氨基噻唑并噻唑腈化物與羰基化合物進行反應時,在產物中不僅分離得到了Friedlander反應物、PDF縮合產物,還得到了兩者交叉縮合的產物,其結構獲得了單晶測定的證實(Scheme 7).
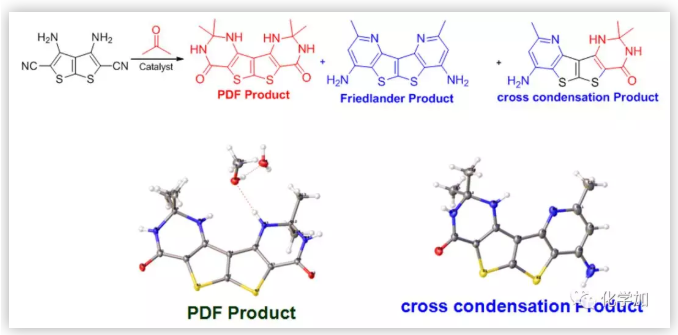
Scheme7
而且,令人驚訝的是,一些對稱的鄰氨基噻吩腈化物與芳香醛經過PDF轉化所得到的產物具有異常高的熱分解溫度。共價有機小分子能有如此高的熱穩定性,不可思議。高度對稱的、分子量在1000左右的近似剛性的C60和葫蘆脲也不過在700oC左右,高能鈍感炸藥TACOTA也不過420oC,其原因(機理)值得探索。a)1H,3H-喹唑啉酮-2,4-二酮創新合成及藥物改進研制。在用鄰氨基腈與對二苯甲醛的PDF轉化中發現,鄰氨基腈可以與DMF進行改進的PDF轉化快捷生成喹唑啉二酮,而喹唑啉二酮是合成阿呋唑嗪等臨床藥物的重要中間體(Scheme 8)。目前,它們的合成均需要經過劇毒的腈酸,使用、環保均較麻煩,改用我們的新工藝則可以快捷、綠色、環保實施轉化。

Scheme 8
b)西地那非骨架的創新合成。輝瑞等公司生產西地那非均需要經過酰胺縮合、關環和脫氫芳構化等步驟完成核心骨架的構建;改用PDF轉化只需一步就可以由鄰氨基腈與醛形成核心骨架(Scheme 9)。
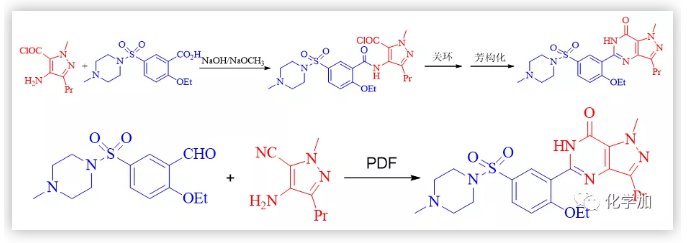
Scheme 9
迄今為止,國內外已經有多個課題組參與到PDF轉化的研究之中,一些新的技術如微波、研磨、有機胺和卡賓催化等均可在PDF轉化上獲得應用。系統的工作表明:PDF轉化具有很好的底物普適性,是構建多氮雜環、特別是喹唑啉酮的經濟、高效合成方法。由于多氮雜環骨架物的光譜生物活性,正在設計研究的西地那非電子等排體,已經發現具有優異的生物活性。后續工作中,值得將將氨基、腈基和羰基的三官能團雙分子反應全面引向親核、親電和鉚合基團相組合的三官能團三分子之間的轉化;深入開展含有PDF轉化的應用研究,爭取在創新藥物和功能材料領域取得突破。[1] Li, J. R.; Ma, S. L. A newand efficient synthesis of 2H-3,1-benzoxazinecompounds [J]. Chin. Chem. Lett., 2005, 16, 1424-1426.[2] Li, J. R.; Zhang, L. J.;Shi, D. X.; et al. Investigation ofthe reaction of o-aminonitriles withketones: A new modification of Friedl?nder reaction and structures of itsproducts [J]. Synlett, 2008, 2, 233-236.[3] Li, J. R.; Chen, X.; Shi, D. X.; et al. A new and facile synthesis of quinazoline2,4(1H, 3H)-diones[J]. Org. Lett., 2009, 11, 1193-1196.[4] Yang, L. P.; Shi, D. X.; Chen, S.; et al. Microwave-assisted synthesis of 2,3-dihydro-pyrido[2,3-d] pyrimidin-4(1H)-ones catalyzed by DBU in aqueous medium [J]. Green Chem., 2012, 14, 945-951.[6]Liu, M. X.; Li, J. R.; Chen, S.; et al. One-pot NHC-assistedaccess to 2,3-dihydropyrimido [4,5-d]pyrimidin-4(1H)-ones [J]. RSCAdvances, 2014, 4, 35629-35634.[5] Liu, M. X.; Li, J. R.; Zheng, K.; et al. Base-catalyzedone-pot tandem reaction: an effective strategy for the synthesis ofpyrazolo[3,4-d]pyrimidinone derivatives [J]. Tetrahedron, 2015,71, 7658-7662.[7] Qiu, F.D.; Yang, J. J.; Shi, D. X.; et al.Synthesis of thieno[2,3-b]thiophenefused pyrimidine derivatives viasequential conversion of 3,4-diaminothieno[2,3-b]thiophene-2,5-dicarbonitrile with carbonyl compounds [J]. Tetrahedron Lett., 2016, 57, 1210-1214.