

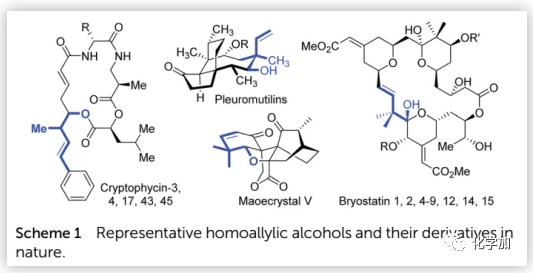
高烯丙基醇及其衍生物不僅是常見的合成中間體,還廣泛存在于許多生物活性化合物和天然產物中(Scheme 1)。例如,cryptophycin家族產物顯示出對實體瘤的突出活性,pleuromutilins抑制革蘭氏陽性病原體的生長,maoecrystal V顯示出對HeLa細胞系的潛在選擇性,bryostatins對多種癌癥和其他疾病具有顯著的生物活性。因此,高烯丙基醇的催化合成一直是有機化學研究的熱點之一。
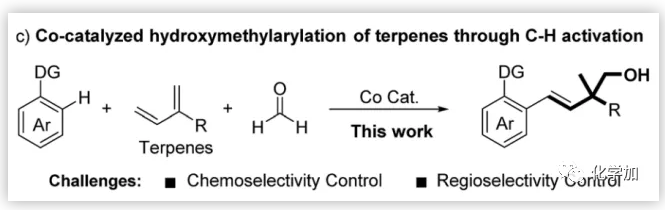
過渡金屬催化的酮/醛與1,3-二烯的還原烯丙基化是構建高烯丙基醇的有效方法。芳烴、二烯和羰基化合物之間的三組分串聯反應可以實現復雜分子的快速組裝,但相關研究依然有限。通過金屬轉移途徑,化學家們已經實現了Ni-或Pt-催化的有機金屬試劑與異戊二烯和醛的三組分加成(Fig. 1a)。從原子和步驟經濟性來看,萜烯和羰基化合物上的定向C-H鍵加成是更具吸引力的方法。最近,Ellman和趙東兵等人分別報道了Co-和Rh-催化的二烯和醛上的C-H鍵加成。然而,當萜烯作為底物時,反應收率不理想且實例有限(Fig. 1b)。受上述研究的啟發,四川大學周向葛課題組和中國科學院大連化學物理研究所陳慶安課題組團隊設想開發一種萜烯與甲醛和芳烴之間的羥甲基化方法,該方法面臨以下挑戰:1)化學選擇性控制:就親電性而言,甲醛是比萜烯更好的偶聯配偶體;2)區域選擇性控制:萜烯具有至少兩個類似的C=C鍵,與碳-金屬絡合物的遷移插入至少存在四種不同的取向(Fig. 1c)。近日,該團隊實現了鈷催化的萜烯與甲醛和芳烴之間的羥甲基化。

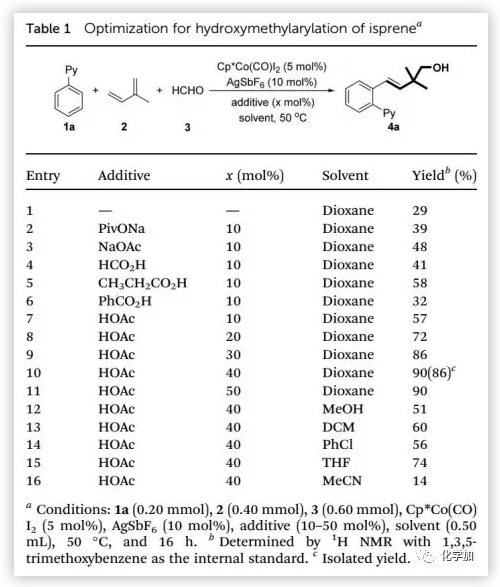
首先,作者用2-苯基吡啶、異戊二烯和多聚甲醛作為模型底物開展研究(Table 1),并在Cp*Co(CO)I2(5 mol%)和AgSbF6存在下以29%的收率得到高烯丙基醇4a。通過對添加劑的考察發現,羧酸鹽和羧酸均能加速反應,可能是通過協同金屬化-去質子化途徑促進C-H活化。值得注意的是,將乙酸的量增加至40 mol%時,收率更好。通過篩選溶劑發現,1,4-二氧六環是最佳溶劑。
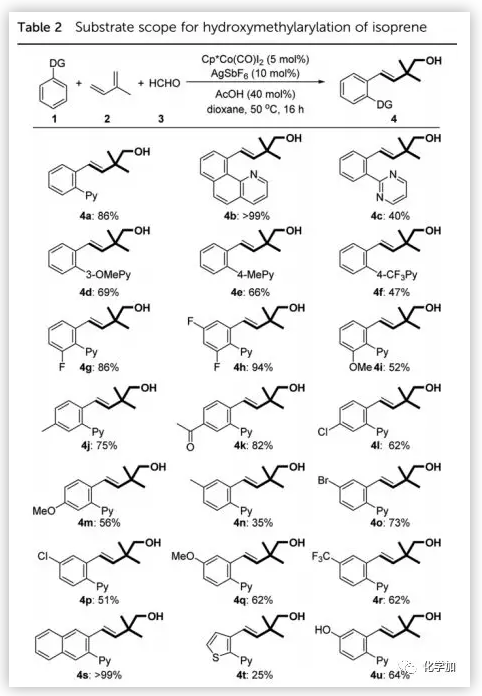
在確定了最佳反應條件后,作者考察了該反應的底物范圍(Table 2)。在標準條件下,苯并喹啉可以幾乎定量的收率得到高烯丙基醇4b;2-苯基嘧啶以及在吡啶上含吸電子或給電子取代基的底物均是合適的底物。隨后,作者進一步考察了苯環上的取代基。氟取代的芳烴可以順利進行反應并以良好的收率(>85%)得到相應的產物。給電子基團如甲氧基和甲基不受取代位置影響,均具有良好的耐受性。此外,該方法還可以擴展到羥基取代的芳烴和含吸電子取代基(如乙酰基、氯、溴和三氟甲基)的底物。值得注意的是,所有間位和對位取代的芳烴均得到單一的區域異構體,而且2-萘基衍生的芳烴可以定量轉化為高烯丙基醇4s。
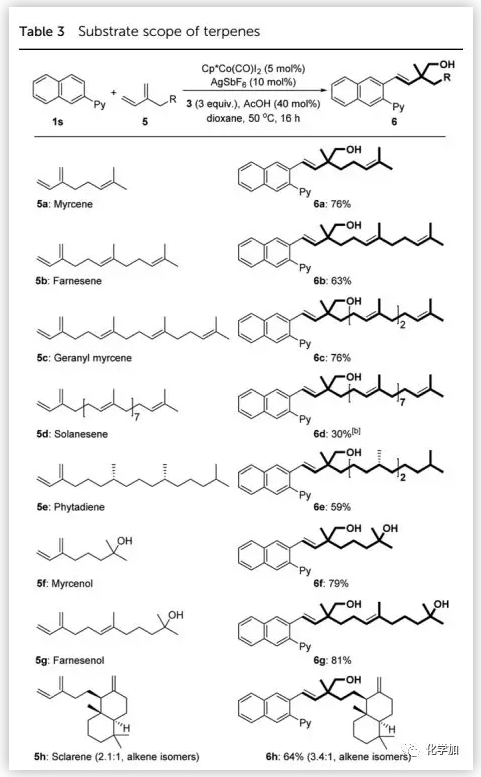
接下來,作者考察了萜烯的適用范圍(Table 3)。異戊二烯單元由2增加到4(5a、5b、5c)對反應性沒有顯著影響;然而,羅勒烯(5a的異構體)與甲醛和芳烴之間的反應未得到目標產物。由于含9個異戊二烯單元的solanesene(5d)的溶解性差,使得目標產物的收率較低;天然萜類化合物myrcenol(5f)和farnesenol(5g)的反應收率良好(79-81%);源自葉綠素的phytadiene(5e)和雙環二萜sclarene(5h)也適用于該轉化。
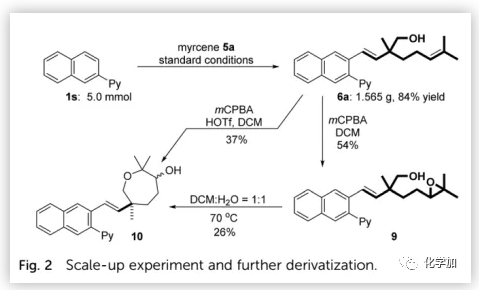
為了驗證該方法的實用性,作者進行了克級規模反應并以84%的收率得到羥甲基化產物6a(Fig. 2),其經m-CPBA氧化得到環氧化物9(54%),并伴有少量七元環產物10。值得注意的是,質子溶劑(DCM/H2O,1:1)可促進環氧化物9的開環;因此,利用HOTf(30 mol%)作為添加劑,可以由6a直接合成10(37%)。
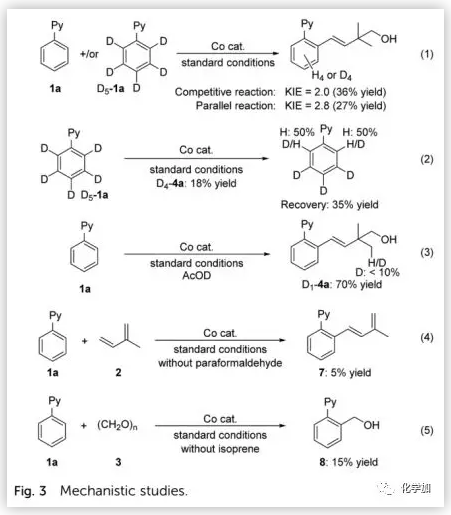
為了探索該反應的機理,作者進行了一些對照實驗(Fig. 3)。在標準條件下,作者利用1a+/或D5-1a進行了動力學同位素效應(KIE)實驗,并且平行反應和競爭反應的KIE值分別為2.8和2.0(eq 1),表明C-H鍵的斷裂可能是決速步驟。在回收的起始原料中存在氫原子取代的產物,表明在鈷催化下存在可逆的C-H活化過程(eq 2)。當用AcOD作為添加劑時,目標產物的收率為70%,其中氘代發生在甲基上(D1-4a),表明該過程中涉及相對較少的H-D交換(eq 3)。當甲醛不參與反應時,發生異戊二烯與1a的氧化偶聯,但由于沒有外部氧化劑使得反應收率低(eq 4)。在不存在異戊二烯的情況下,可以得到少量羥基化產物8;然而,在標準條件下,卻未得到羥基化產物8(eq 5)。兩種組分的偶聯結果(eq 4和5)均表明,萜烯與甲醛對形成的芳基鈷中間體的配位能力不同,可能是導致其具有化學選擇性的主要原因。
為了更好地解釋產生區域選擇性的原因,作者詳細介紹了生成區域特異性高烯丙醇產物的潛在途徑(Fig. 4)。基于不同的加成取向,將五元鈷絡合物A(生成于鈷預催化劑和1a之間的C-H活化步驟)與異戊二烯加成可以產生四種加成模式(B1、B2、B3和B4)。然而,由于空間位阻(B1和B2)或β-消除問題(B3),1,2-/2,1-或3,4-加成產物基本不會產生。相反,4,3-加成產物B4可以通過β-消除產生C;然后,Co-H 鍵1,4-插入至異戊二烯單元中得到中間體D;最后,D與甲醛通過“椅式”過渡態(E)定向加成得到高烯丙基醇產物4a,并再生鈷催化劑。

總結:川大周向葛課題組和大連化物所陳慶安課題組團隊開發了一種鈷催化的萜烯與多聚甲醛和芳烴之間的羥甲基化方法,其化學選擇性主要是萜烯和甲醛之間的配位能力差異引起的,并且異戊二烯和導向基團的空間位阻和配位能力決定了區域選擇性。此外,通過C-H加成途徑,這種萜烯的雙官能團化還具有高原子經濟性和步驟經濟性。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn