



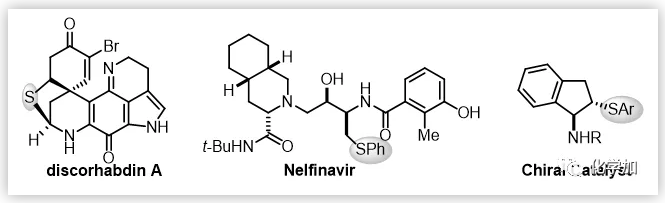
手性硫化合物廣泛存在于活性天然產(chǎn)物和藥物分子中,在不對稱催化中也扮演著重要角色;同時它們也是一類很重要的合成中間體,被廣泛用于天然產(chǎn)物及藥物的合成中(圖1)。目前關(guān)于手性硫化合物的不對稱合成方法主要集中在硫親核加成,硫葉立德的2,3-重排,親電性的硫醚化反應(yīng)。其中,烯烴的不對稱催化硫醚化反應(yīng)是合成這類化合物最直接有效的方法。
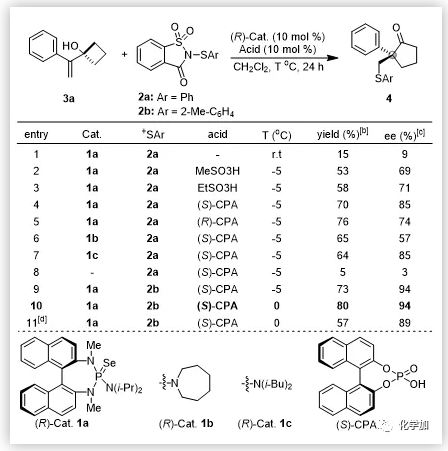
在過去的十幾年中,Denmark課題組使用手性路易斯堿和非手性布朗斯特酸實現(xiàn)了烯烴的硫醚化反應(yīng);史一安課題組使用手性布朗斯特酸同樣實現(xiàn)了該類反應(yīng)。盡管如此,由于反應(yīng)以及底物類型的局限性,手性硫化合物的合成方法仍然是很有限的。例如,由于1,1-二取代和三取代烯烴底物反應(yīng)過程中的面選擇性較難控制,使得這兩種底物在不對稱硫醚化反應(yīng)中只能得到很低的對映選擇性。但由于該類底物能夠快速構(gòu)建具有手性季碳中心的分子結(jié)構(gòu)單元,且它們普遍存在于藥物和天然產(chǎn)物中。因此,很有必要去實現(xiàn)該類底物的高對映選擇性反應(yīng)。
近日,上海交通大學(xué)涂永強院士和陳志敏特別研究員設(shè)計以1,1-二取代烯丙醇為底物,利用手性的路易斯堿/布朗斯特酸共催化體系首次實現(xiàn)了1,1-二取代或三取代烯烴的不對稱Sulfenylation/Semipinacal重排反應(yīng),最終構(gòu)建了一系列含有手性季碳中心的β-硫芳基酮化合物并將其用于天然產(chǎn)物(-)-herbertene的高效合成。
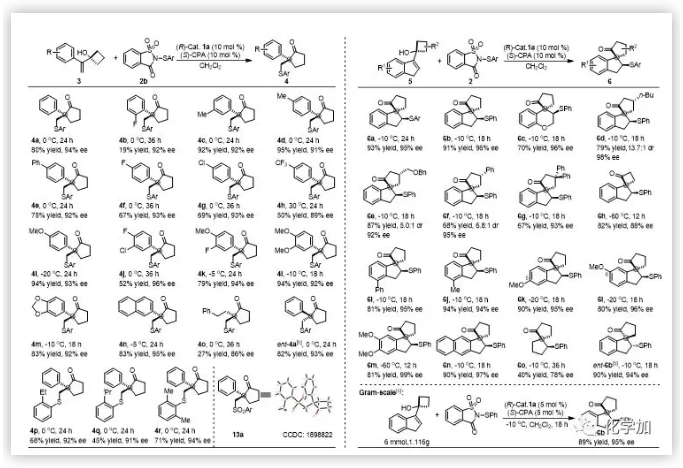
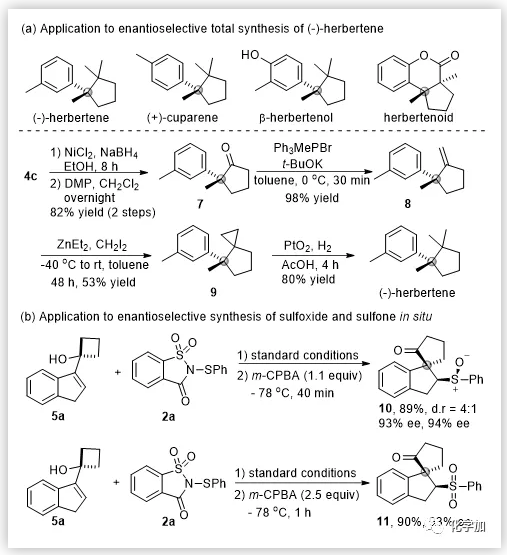
隨后,作者對反應(yīng)的實用性進行了研究。β-硫芳基酮產(chǎn)物通過簡單的幾步轉(zhuǎn)化就可以合成天然產(chǎn)物(-)-herbertene(圖4)。此外,通過原位加入氧化劑,作者也以優(yōu)異的產(chǎn)率和優(yōu)異的對映選擇性實現(xiàn)了一鍋法手性亞砜和砜的合成。
基于之前的工作,作者認為向該催化體系中加入(S)-CPA后先形成了活性中間體物種12a。作者通過低溫31P -NMR實驗,驗證以上的猜想。為了進一步理解反應(yīng)的對映選擇性的控制過程和手性Br?nsted酸的作用,作者還與蘇州大學(xué)鮑曉光課題組合作進行了計算研究(圖5,6)。

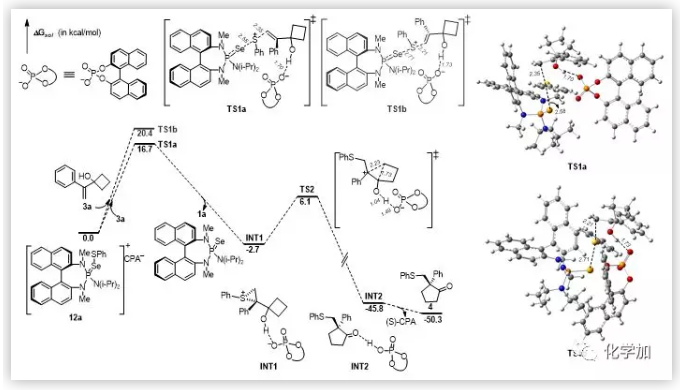
總結(jié):上海交通大學(xué)涂永強院士和陳志敏特別研究員使用手性路易斯堿和布朗斯特酸作為共催化劑,首次成功地實現(xiàn)了1,1-二取代和三取代烯丙醇的對映選擇性Sulfenylation/Semipinacal重排反應(yīng)。該方法提供了一種有效,直接和容易合成β-硫芳基酮的途徑。此外,高效合成天然產(chǎn)物(-)-herbertene和一鍋法合成手性亞砜和砜證明了該方法的合成有用性。克級規(guī)模實驗的成功表明對映選擇性亞磺酰化反應(yīng)可轉(zhuǎn)化為制備規(guī)模。計算研究結(jié)果進一步證明了手性路易斯堿和布朗斯特酸的共催化作用。
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn