

叔膦催化已越來越受到化學家們的關注,特別是缺電子聯烯1在叔膦催化下通過兩性離子中間體A可發生豐富的環化反應 (圖1)。陸熙炎院士的[3+2],Kwon教授的[4+2]以及童曉峰教授的[4+1]環化反應均代表了其重要進展。為了擴大叔膦催化的底物適用范圍,西安交通大學徐四龍和李洋課題組推測貧電子的亞甲基環丙烷(ACPs) 2在叔膦催化下會生成烯丙基鏻鹽中間體B,其具有未開發的反應活性和新的反應潛力。
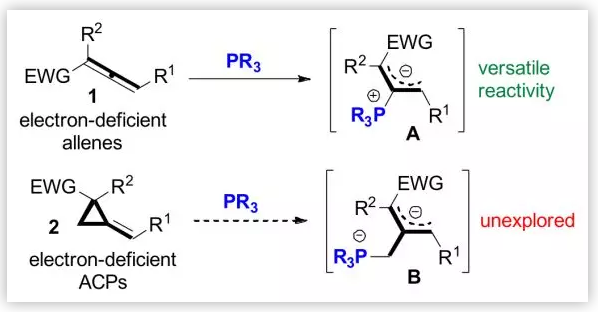
圖1. 膦和缺電子聯烯或ACPs的加成(圖片來源:Angew. Chem. Int. Ed.)
基于中間體B的反應活性,作者在此報道了三種底物控制的膦催化缺電子ACPs的開環重排反應(見下文),分別以良好的產率和化學選擇性地得到了三取代呋喃、四取代呋喃和三取代二烯酮化合物,文章發表在Angew. Chem. Int. Ed.上(DOI:10.1002/anie.201903320),西安交通大學理學院博士生賀馨是文章第一作者,徐四龍副教授和李洋副教授作為共同通訊作者。
最初,受麻生明院士報道的鈀催化缺電子亞甲基環丙基酮重排反應啟發,作者研究了底物2-1a的開環重排反應 (圖2)。令人高興的是,在DMSO中120 °C時,PPh3(20 mol%)催化條件下,2-1a發生開環重排,以78%的產率得到三取代呋喃3a,進一步對一系列烷基和芳基膦考察確定 P(4-MeOC6H4)3的催化活性最好,以81%的收率得到3a。同時發現DABCO也能促進2-1a的開環,但生成了二氫呋喃化合物3a’,產率為54%。降低催化劑量至10 mol%或降低溫度至100 °C均對反應不利。因此最終確定反應條件為:在120 ℃ DMSO中,20 mol%的P(4-MeOC6H4)3催化反應進行。
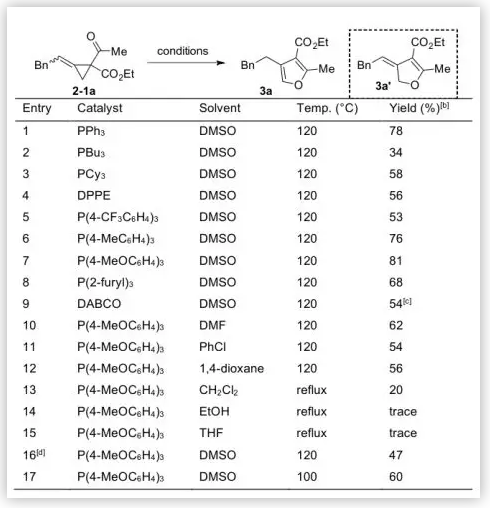
圖2. 反應條件優化(圖片來源:Angew. Chem. Int. Ed.)
在最佳反應條件下,作者考察了缺電子ACPs在叔膦催化下重排合成三取代呋喃的底物范圍(圖3)。不同的吸電子基如酯、酮和砜,反應均能良好耐受,分別以72-81%的收率得到重排產物3a-c。脂肪酮和芳香酮(R3為烷基,芳基)在反應中都是耐受的,芳香酮的產率略低。此外,烯烴的取代基為烷基(R1為烷基)時反應結果良好,如芐基或長鏈烷烴取代,分別以83%和81%的收率生成三取代呋喃3j和3k。
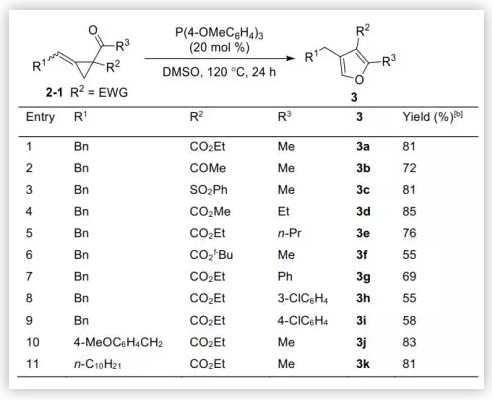
圖3. 合成2,3,4-三取代呋喃(圖片來源:Angew. Chem. Int. Ed.)
有趣的是,當R2從吸電子基變為芳基時,反應會選擇性地重排生成1,2,4-三取代二烯酮4(圖4)。作者對反應條件的考察確定該轉化以PBu3(20 mol%) 在DCE中催化回流為最佳條件。在此條件下,考察了反應的底物范圍:底物中R1或R3可以是烷基或芳基,以良好收率79-90%得到產物4a-c,且具有優秀的立體選擇性。R2為不同取代芳基時,以稍低的E/Z值得到雙烯酮類化合物4d-i,收率良好至優秀。
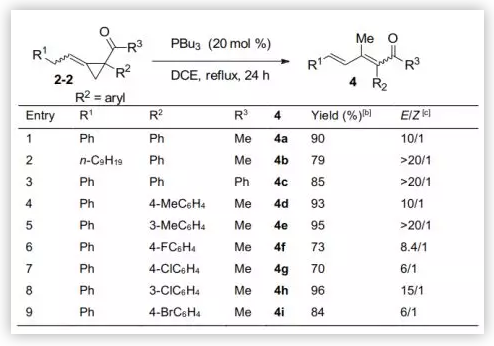
圖4. 合成1,2,4-三取代的二烯酮(圖片來源:Angew. Chem. Int. Ed.)
當烯烴上的烷基取代基變為芳基,阻止二烯烴生成時,重排反應會以高化學選擇性得到四取代呋喃5 (圖5)。值得注意的是,這一反應與麻生明院士等人報道的Pd(PPh3)4催化反應形成較鮮明的對比。最優條件與合成三取代呋喃的條件相同。一系列含不同取代芳基(R1)的缺電子ACPs均能順利轉化,以55-89%的收率得到了全取代的呋喃類化合物。芳香酮也適用于該反應,以61%的收率得到5j。此外,一系列不同取代芳基(R2)在反應中也是耐受的,產物5k-p的收率良好,且具有優秀的化學選擇性。
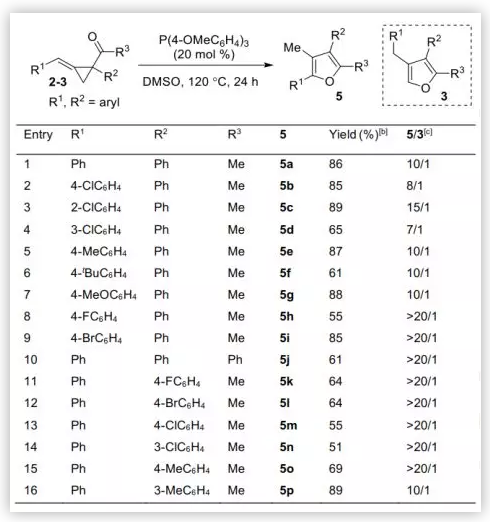
圖5. 合成全取代的呋喃(圖片來源:Angew. Chem. Int. Ed.)
以上叔膦催化貧電子ACPs的多樣性重排反應證明了膦催化ACPs開環所具有的反應活性。這些反應為多取代呋喃和二烯酮的合成提供了新的方法。為了說明以上重排產物的合成用途,作者取三取代呋喃3c與苯炔發生Diels-Alder反應,在非常溫和的條件下可得到1,4-環氧萘6a,產率為64%(圖6)。
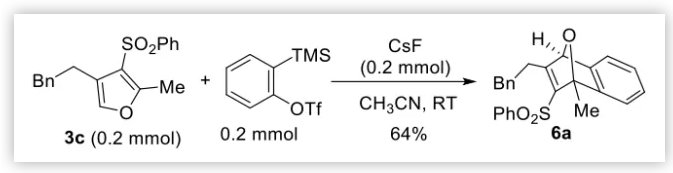
圖6. 3c和苯炔的D-A反應(圖片來源:Angew. Chem. Int. Ed.)
基于上述實驗結果,作者提出貧電子ACPs開環重排可能的機理過程(圖7):首先,叔膦通過親核進攻缺電子ACPs2,得到烯丙基鏻鹽中間體B。從中間體B出發,根據底物中的取代基不同發生了三種不同的重排。Path A中,當R2是吸電子基時,烯醇氧負離子經分子內SN2關環,離去叔膦,生成二氫呋喃3’,3’進一步異構化為芳香性呋喃3。Path B中, R2為芳香基增強了中間體B的堿性,從而促進了分子內1,4-質子遷移,得到中間體C。隨后,1,4-消除離去叔膦并生成二烯4’,然后異構化成熱力學更穩定的二烯酮4。在Path C中,上述1,4-質子轉移由于芳基取代(R1 = 芳基)而受阻,取而代之的是分子內SN2’關環,得到二氫呋喃5’,最終異構化至全取代呋喃5。
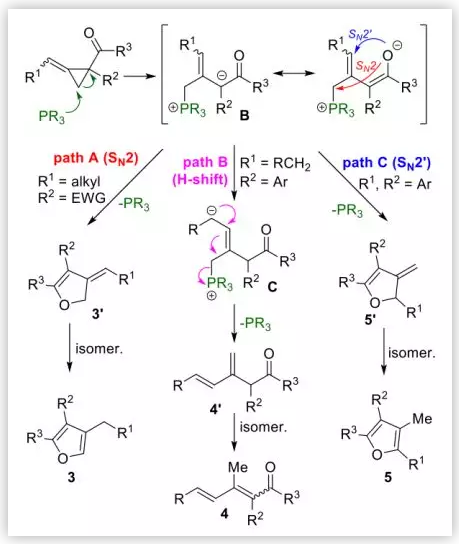
圖7. 可能的反應機理(圖片來源:Angew. Chem. Int. Ed.)
為了進一步闡明該反應機理,作者通過核磁跟蹤了底物2-3q的重排過程(圖8)。當2-3q (0.03 mmol)和PPh3(0.03 mmol)在DMSO-d6(0.6 mL)中120 °C下加熱30 min時,在12.4和12.6 ppm處出現一對新的31P NMR信號,比例為3:2。同時,以13% 的NMR產率檢測到呋喃產物5q。這一結果與以上提出的膦參與重排的機理是一致的,含P的中間體可能對應于中間體B1的E/Z異構體。
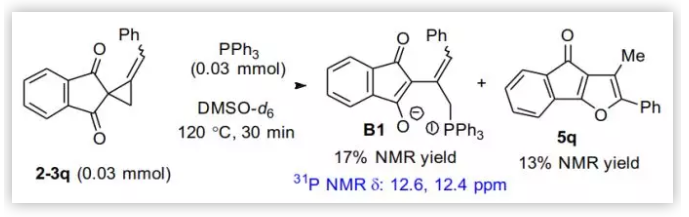
圖8. 底物2-3q重排的膦譜監測(圖片來源:Angew. Chem. Int. Ed.)
總結:西安交通大學徐四龍和李洋課題組報道了三種不同的缺電子亞甲基環丙烷(ACPs)在叔膦催化下開環重排反應模式,分別以良好的產率合成了三取代呋喃、四取代呋喃和三取代二烯酮化合物。ACPs的這種有機催化活化與以前的過渡金屬催化活化形成鮮明對比,因此豐富了ACPs的合成潛力,同時也擴大了膦催化的底物范圍,為膦催化提供了一種新的底物分子。
撰稿人:詩路化語
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn