

苯環是有機化學的基本官能團之一,苯環骨架的構建和引入一直是有機化學的基礎研究課題。在分子中引入苯環結構最具代表性的方法是[4+2]環加成反應,另一種則是含苯環骨架的底物和親電試劑反應,第一種方法十分成熟,而第二種則存在反應選擇性等問題。噻吩是一類重要的化工原料,常作為富電子芳烴與各種親電試劑反應,而其作為雙烯體參與[4+2]環化反應的報道相對少見。眾所周知,噻吩可作為雙烯體與順丁烯二酸酐發生[4+2]環化反應,但反應溫度高達225 °C。此外,有文獻報道可見光或紫外光可促進噻吩參與環化反應,但要么底物范圍局限,要么反應條件苛刻。近日,武漢大學雷愛文教授和江建緯副教授等人基于可見光誘導的自由基離子中間體一些特殊的反應性,報道了一種溫和的噻吩和炔烴[4+2]環化反應,該反應無需金屬參與,具有很高的區域選擇性,且底物范圍廣泛。

(圖片來源:Angew. Chem. Int. Ed)
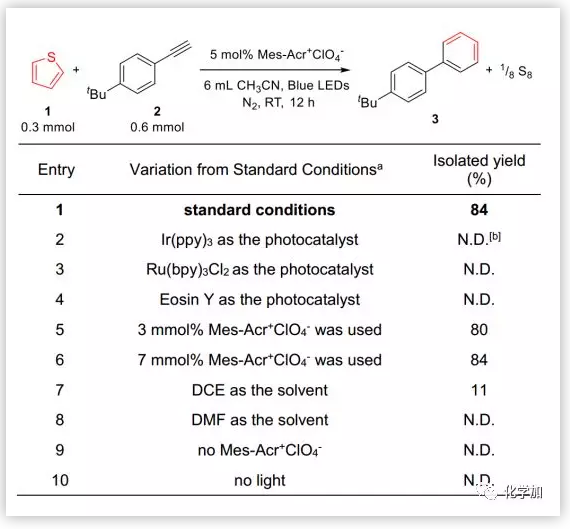
首先,作者對反應條件進行了優化。作者以噻吩和4-叔丁基苯乙炔為模板底物,對反應進行探索。實驗結果表明,以Mes-Acr+ClO4-為催化劑、乙腈為溶劑,在藍光下,于室溫下反應12 h,即可以84%的收率得到目標產物。控制實驗表明,Ir(ppy)3、Ru(bpy)3Cl2、Eosin Y等常見光催化劑并不適用該反應,可能是Mes-Acr+ClO4-將噻吩氧化為自由基陽離子的能力更強。對溶劑進行篩選,發現乙腈效果最好,在無光條件下,該反應不進行。
(圖片來源:Angew. Chem. Int. Ed)
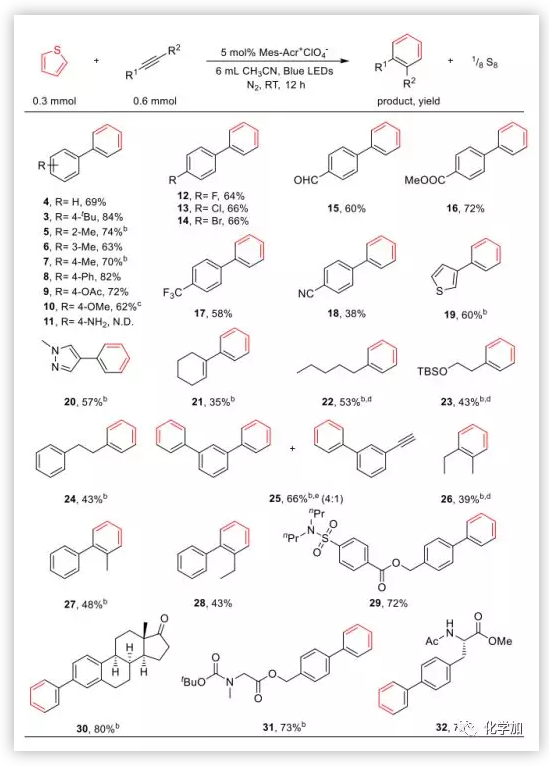
隨后,作者對底物范圍進行了考察。首先固定噻吩作為雙烯體,對不同炔烴的普適性進行了探索。反應能以中等到優秀的收率得到目標產物,給電子取代基反應產率稍高,氨基由于會和光催化劑配位致其失活在反應體系中不兼容。鹵素原子不受影響,F、Cl、Br等取代的苯乙炔能與噻吩以中等的收率得到目標產物,為后續衍生化合成復雜分子提供了可能。除苯乙炔外,雜環、烯基、烷基等取代的炔烴也能參與反應,若底物中含有兩個叁鍵,可以分別和兩個噻吩發生環加成反應一步構建兩個苯環。此外,該方法可以以較高的產率合成諸多復雜生物活性分子(化合物30, 31, 32)。
(圖片來源:Angew. Chem. Int. Ed)
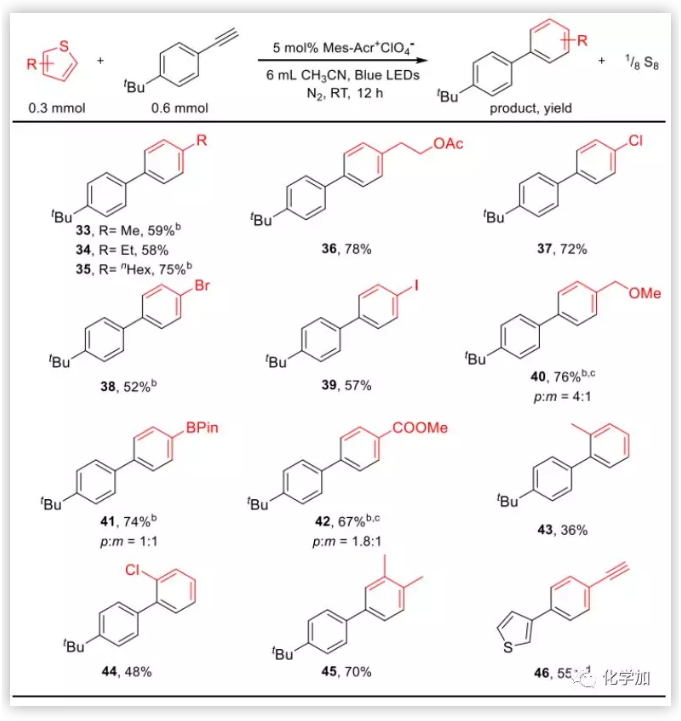
隨后,作者固定4-叔丁基苯乙炔作為親雙烯體,對噻吩底物的普適性進行了探索。反應的官能團兼容性很好,2-取代和3-取代的噻吩都能很好的參與反應,OAc、Cl、Br、I、Bpin、COOMe等基團不受影響,特別是Bpin官能團為后續衍生化提供了諸多可能。對于2-取代噻吩,由于位阻影響,產率會有降低。
(圖片來源:Angew. Chem. Int. Ed)
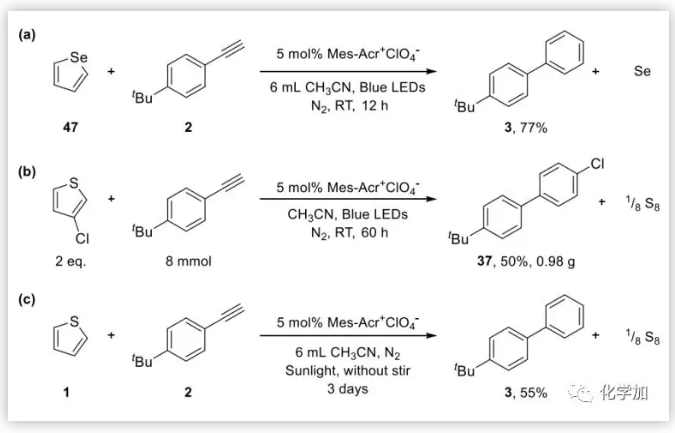
除噻吩外,硒噻吩也能發生類似的[4+2]環化反應。以硒噻吩和4-叔丁基苯乙炔為底物,反應能以77%的收率得到目標產物;該反應可以實現克級放大,產率仍有50%;另外,在日光下,反應也能以較高的收率得到目標產物,但反應時間需要延長。
(圖片來源:Angew. Chem. Int. Ed)
基于一些機理實驗和DFT計算,作者提出了如下可能的反應機理。Mes-Acr+ClO4-在光照下將噻吩氧化成自由基陽離子I,隨后與炔烴發生[4+2]環加成得到新的自由基陽離子II,隨后與失去一個電子的Mes-Acr+ClO4-發生一個單電子轉移歷程得到中間體III(可被HRMS高分辨質譜監測到),最后脫去硫單質恢復芳香性得到目標產物。
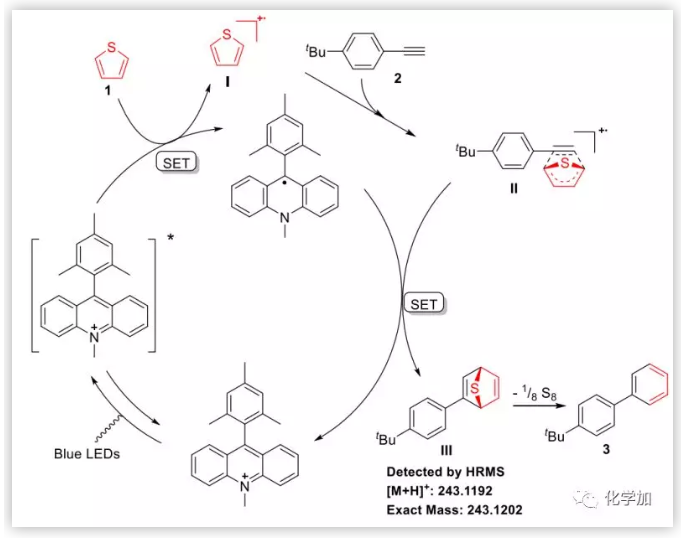
(圖片來源:Angew. Chem. Int. Ed)
總結:武漢大學雷愛文教授和江建緯副教授等人報道了一種可見光誘導的噻吩和炔烴脫硫的[4+2]環化反應。與傳統反應相比,該方法反應條件溫和,產率中等到優秀,且底物范圍廣,為多取代芳烴的合成提供了新的思路。
撰稿人:貓咪老師
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn