

據統計,預計到2030年,胰腺癌將成為美國癌癥相關死亡的第二大疾病。而死亡的主要原因之一是腫瘤轉移。因此,在藥物發展中急需能夠阻止腫瘤轉移的新方法以及新藥物。
關鍵膜受體的分布和降解在腫瘤細胞的侵襲和轉移中起著至關重要的作用。肌纖維素(MYOF)是一種內吞和囊泡轉運相關的膜蛋白,在胰腺癌、乳腺癌、細胞淋巴瘤和肺癌中有明顯的高表達,而在正常組織中不表達。有文獻表明,MYOF通過調節轉移相關蛋白如表皮生長因子受體(EGFR),血管內皮生長因子受體2(VEGFR 2)和基質金屬蛋白酶(MMPs)的活性參與癌細胞的遷移和侵襲。此外,MYOF是維持胰管腺癌線粒體分支結構和高氧化磷酸化活性所必需的,影響胰腺癌細胞的能量代謝。因此,應用新型MYOF調節劑治療轉移性胰腺癌是一種很具吸引力的治療方法。
華東師范大學陳益華、易正芳、劉明耀課題組報導了一系列的1,5-二芳基-1,2,4-三唑衍生物,活性測試表明,先導化合物6y在體內外均顯示出有效的抗胰腺癌活性。相關研究表明,6y可能與新型抗腫瘤轉移靶點肌鐵蛋白(MYOF)結合,調控囊泡轉運和轉移相關蛋白。機制研究表明,6y通過逆轉上皮間充質轉移,抑制基質金屬蛋白酶分泌,阻斷受體酪氨酸激酶,抑制胰腺癌轉移。
在該課題組以往的研究基礎上,作者將2,3-二芳基-4-噻唑啉酮類化合物2a作為先導化合物進行結構修飾。作者將母核結構換為三氮唑,增加抗轉移活性;將二芳基換為親水性雜環芳香類結構以改善其理化性質,對鹵代苯乙基側鏈也進行了優化(Figure 2)。
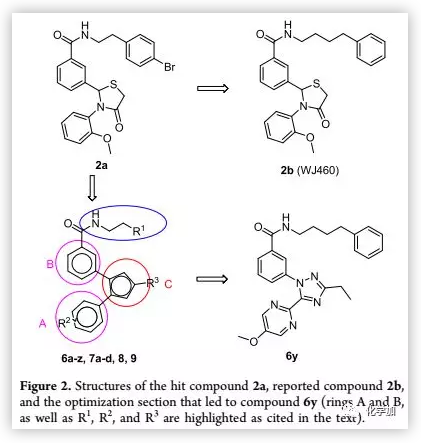
(來源:J. Med. Chem.)
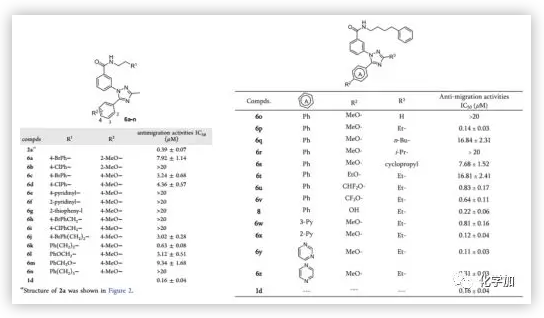
通過對所有設計的化合物進行抗轉移活性測試,作者發現化合物6y(IC50 = 0.11 μM)表現出與陽性對照1d(IC50 = 0.16 μM)相當的抗遷移活性。
(來源:J. Med. Chem.)
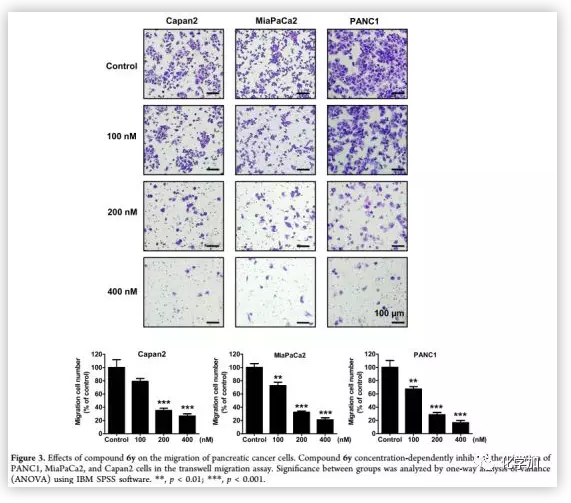
為了進一步驗證6y的抗遷移活性,作者選擇了另外兩個胰腺癌細胞系MiaPaCa 2和Capan 2進行細胞遷移實驗(Figure 3)。結果表明,6y濃度依賴性地減少了MiaPaCa 2和Capan 2細胞遷移的細胞數,表明其對胰腺癌細胞的運動有較強的抑制作用。
(來源:J. Med. Chem.)
由于化合物6y具有潛在的抗轉移、抗入侵活性及良好的理化性質,因此,作者在細胞模型的基礎上對其毒性進行考察。作者利用MTS法對人胰腺癌細胞系(MiaPaCa 2和PANC1細胞)和正常人細胞系(HPED6-C7, HAF和MCF-10A)測定半數最大抑制濃度(IC50)(Table 5)。結果表明,化合物6y對3株胰腺癌細胞的IC50值為2.85?0.84 μm,在3株正常人細胞系的IC50值為8.54?27.56 μm。為了排除6y的細胞毒性導致抑制細胞遷移的可能性,作者用不同濃度(0.1,0.3,1.0μm)的6y對PANC1進行了額外的實驗(Figure S1)。結果表明,化合物6y對PANC1的細胞毒性不影響其抗腫瘤作用。
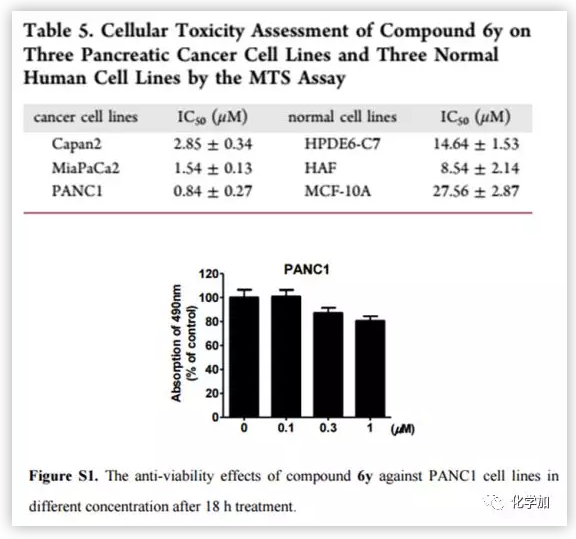
(來源:J. Med. Chem.)
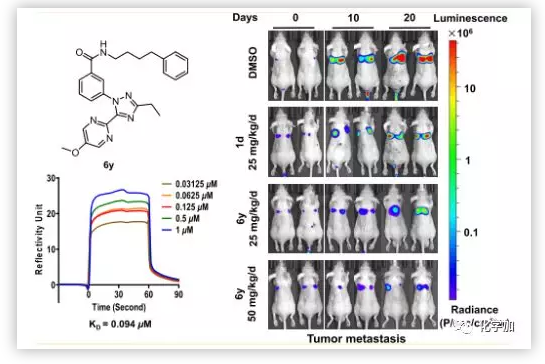
作者為了探討本系列化合物的可能靶點, 采用SPR生物傳感器對肌C2D結構域與3種代表性化合物(6p,6k,6y)的相互作用進行了研究。6k是最先被測定出在PANC1細胞抗轉移活性測試中IC50值低于1 μm的化合物,6p由于C環中乙基的取代使生物活性增加了大約4倍(6p vs 6k),因此可用于觀察相應的結合親和力變化。6y具有最佳的抗菌、抗入侵活性和最優良的理化性能。結果顯示 ,化合物6y與肌球蛋白C2D蛋白呈濃度依賴性和可逆性結合,Kd值為0.094 μm(Figure 4)。
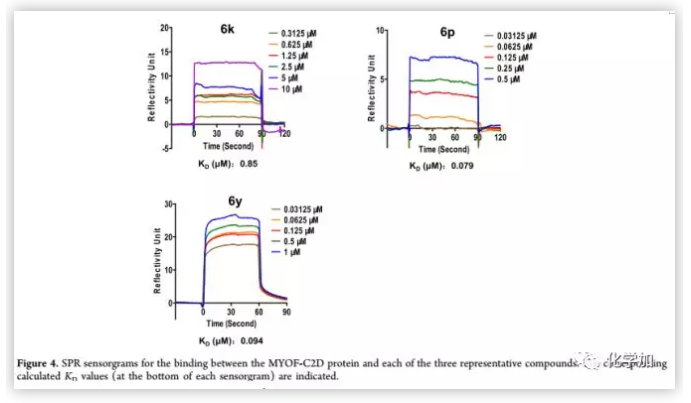
(來源:J. Med. Chem.)
STD是研究配體?受體相互作用的最有力的核磁共振技術之一。作者利用STD-NMR技術,觀察了化合物6y與MYOF的直接結合(Figure 5)。與SPR實驗結果一致,在STD譜中觀察到6y與MYOF的直接結合。嘧啶和甲氧基的SDD信號較弱,表明嘧啶(環A)和甲氧基基團比環B更易溶于溶劑。相反,位于N取代側鏈尾部的苯環上的質子1和環C上乙基取代處的質子表現出最強的STD信號,表明這些質子被掩埋在蛋白質中。
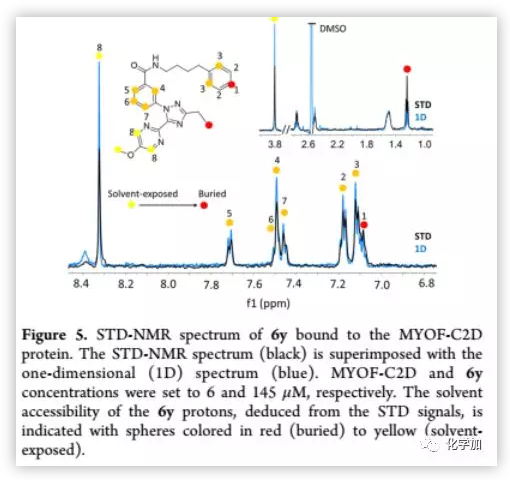
(來源:J. Med. Chem.)
化合物6y通過SPR和STD-MR實驗證明與MYOF結合,且具有良好的生物活性和理化性質。為了確定6y的生物學效應是否與MYOF有關,作者對MYOF基因敲除細胞和MYOF過表達細胞進行了6y敏感性試驗(Figure 6)。結果表明,MYOF基因敲除的PANC 1細胞減少了遷移,顯示出MYOF在遷移中的關鍵作用。PANC 1細胞株對MYOF的基因消融導致細胞對6y的敏感性降低。基因拯救表達MYOF恢復化合物6y的抗移植物活性,表明6y通過與MYOF作用,抑制了癌細胞遷移。
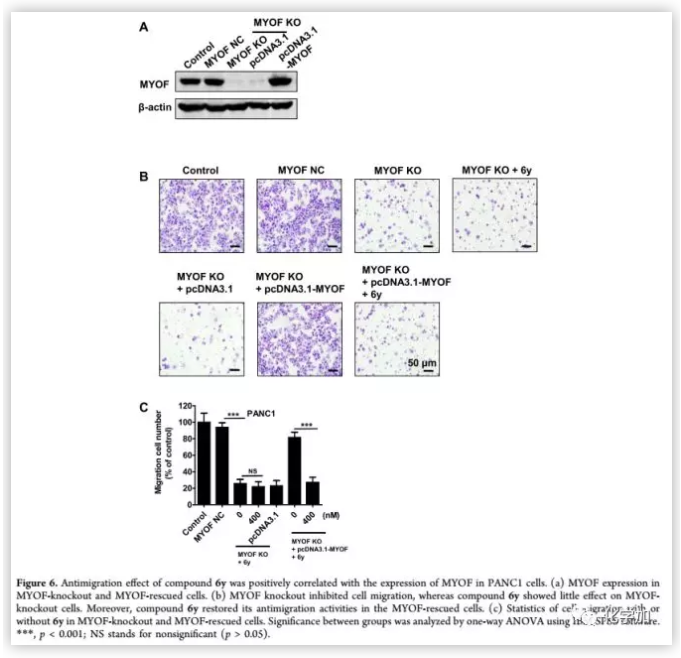
(來源:J. Med. Chem.)
因為6y能夠明顯的抑制胰腺癌的轉移和增殖,并且對MYOF有結合作用,作者在基于熒光素酶的動物生物發光成像技術基礎上,以BALB/c裸鼠胰腺癌肺轉移模型測試了6y的抗轉移活性(Figure 7)。結果顯示,6y呈劑量依賴性抑制胰腺癌肺轉移,且抗腫瘤轉移活性優于同劑量陽性對照組。在第20天,處理組的平均發光下降約3倍和5倍(分別為25和50 mg/(kg·d))。表明肺轉移負擔明顯減輕。3周后存活率分別為25%(陰性對照)、60%(陽性對照)、75%(6y,25 mg/(kg·d))和87.5%(6y,50 mg/(kg·d)。證明化合物6y顯著延長了整體存活時間。

(來源:J. Med. Chem.)
最后,作者對化合物6y抗腫瘤轉移的可能機制進行了研究。EMT是細胞極性喪失、間充質和遷移表型產生的過程,促使腫瘤細胞向侵襲性表型轉移。因有報道稱MYOF基因消融可逆轉乳腺癌細胞的EMT,作者探討了PANC 1細胞的EMT過程是否受6y的影響。Western blot結果顯示,6y可以逆轉胰腺癌細胞進入上皮狀態。在腫瘤轉移過程中,癌細胞會分泌多種MMPs降解細胞外基質和基底膜來促進腫瘤轉移和侵襲。作者對經6y處理的PANC 1細胞的培養基進行收集濃縮,發現6y梯度依賴性抑制PANC 1細胞中MMP1和MMP2的分泌。
MYOF是RTK循環的關鍵調節因子,而VEGFR和EGFR是胰腺癌臨床治療的兩個主要的RTK藥物靶點。因此作者檢測了6y對VEGFR和EGFR的影響。Western blot分析顯示,6y可降低PANC 1細胞中VEGFR 2和EGFR 2的水平。6y處理PANC1細胞可引起EGFR在10 ng/ml EGF刺激下的持續磷酸化,阻斷EGFR信號通路。這些結果表明,6y通過VEGFR 2和EGFR 2通路以劑量依賴的方式抑制腫瘤轉移。

(來源:J. Med. Chem.)
總結:華東師范大學陳益華、易正芳、劉明耀課題組報導了一種新的預防胰腺癌轉移的治療策略。通過對一系列二芳基1,2,4-三唑衍生物進行篩選,作者發現化合物6y以納摩爾的IC50值抑制胰腺癌轉移和增殖,SPR分析表明,6y與MYOF-C2D具有納摩爾級的親和力。STD-NMR實驗表明,芳香尾鏈是該抑制劑最隱蔽的區域,而A環則是該化合物中溶劑暴露程度最高的部分。化合物6y對MYOF基因敲除細胞沒有明顯的抑制作用,并恢復了對MYOF基因敲除細胞的活性。更重要的是,化合物6y能有效地阻斷PANC 1在體內的轉移,而沒有表現出明顯的毒性。MYOF抑制劑可能通過逆轉EMT,抑制MMP1和MMP2的分泌,同時影響VEGFR 2和EGFR的磷酸化而發揮其作用。
撰稿人:安fen
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn