



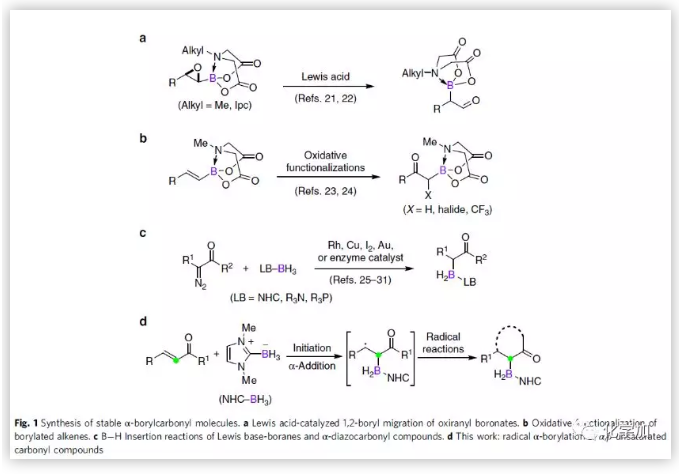
有機硼化合物廣泛應(yīng)用于化學(xué)合成、藥物化學(xué)以及材料科學(xué)中,該化合物的合成受到化學(xué)家的廣泛關(guān)注。α,β-不飽和羰基化合物的硼基化反應(yīng)是合成該化合物最有效的方法之一。β-硼基羰基化合物的合成已經(jīng)取得了不錯的進(jìn)展,但直接合成α-硼基羰基化合物仍然面臨巨大的挑戰(zhàn)。目前已有的關(guān)于直接合成α-硼基羰基化合物的方法包括:Lewis 酸催化環(huán)氧乙烷硼酸酯的1,2-硼酸轉(zhuǎn)移反應(yīng)(Fig. 1a);烯基硼酸酯的氧化官能團(tuán)化反應(yīng)(Fig. 1b);Lewis堿-硼烷與α-二氮羰基化合物B-H鍵的插入反應(yīng)(Fig. 1c)。但這些方法起始原料的合成步驟冗長,這極大地限制了硼化合物的官能團(tuán)化反應(yīng)及其應(yīng)用潛力。在上述背景研究的基礎(chǔ)上,中國科學(xué)技術(shù)大學(xué)周曉國、汪義豐、傅堯團(tuán)隊報道了首例NHC-BH3與α,β-不飽和羰基化合物的區(qū)域選擇性自由基α-硼基化反應(yīng) (Fig. 1d)。
(圖片來源:Nat. Commun.)
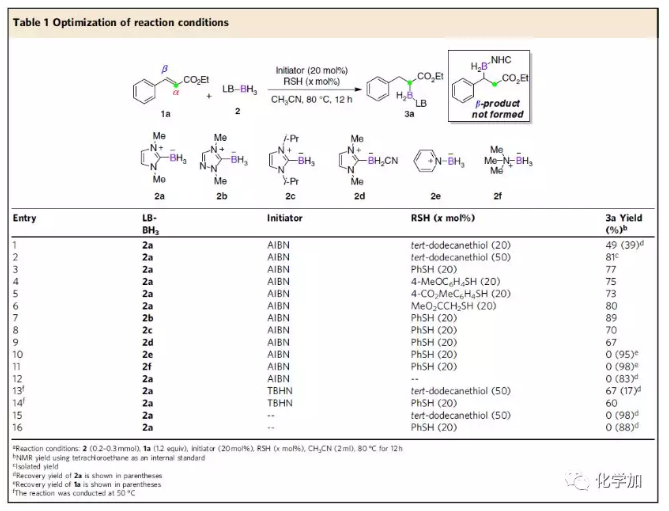
以肉桂酸乙酯1a和NHC-硼烷2a為模板底物,作者對反應(yīng)條件進(jìn)行反復(fù)篩選,發(fā)現(xiàn)20 mol% AIBN為最優(yōu)自由基引發(fā)劑,50 mol%叔十二烷硫醇或20 mol% 苯基硫醇為最優(yōu)極性反轉(zhuǎn)催化劑,CH3CN為最優(yōu)溶劑,在80 °C條件下反應(yīng)12 h,能以81%或77%的收率得到目標(biāo)產(chǎn)物。值得一提的是,在最優(yōu)反應(yīng)條件下,各種Lewis堿-硼烷均能很好的適應(yīng)反應(yīng)條件,能以較高的收率得到目標(biāo)產(chǎn)物(Table 1)。
(圖片來源:Nat. Commun.)
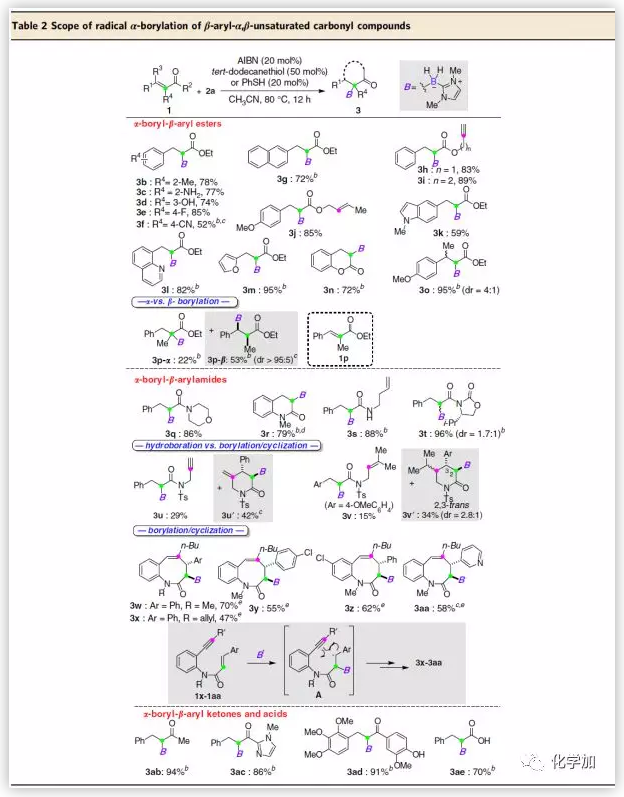
在最優(yōu)反應(yīng)條件下,作者對各種α,β-不飽和羰基化合物的底物范圍進(jìn)行了考察(Table 2)。各種芳基、簡單的烯烴、炔烴和各種β-雜芳基取代的α,β-不飽和酯能很好的適應(yīng)反應(yīng)條件,可以較好的收率得到相應(yīng)產(chǎn)物。若增加1p的α-位的空間位阻,則會生成α-加成和β-加成混合物且β-加成產(chǎn)物為主產(chǎn)物。各種α,β-不飽和酰胺、α,β-不飽和酮和α,β-不飽和酸也能較好的適應(yīng)反應(yīng)條件,能以較高的收率得到相應(yīng)產(chǎn)物。含手性惡唑烷酮的酰胺也能以優(yōu)秀的收率得到相應(yīng)產(chǎn)物,但其非對映選擇性較低。有趣的是,1,6-烯炔1u和1,6-二烯1v取代的酰胺可發(fā)生硼化/環(huán)化串聯(lián)反應(yīng),能以較低的收率得到6元內(nèi)酰胺產(chǎn)物。同時,N-(2-乙炔基)肉桂酰胺也可發(fā)生硼化/環(huán)化串聯(lián)反應(yīng),能以較高的收率得到相應(yīng)的8元內(nèi)酰胺產(chǎn)物。
(圖片來源:Nat. Commun.)
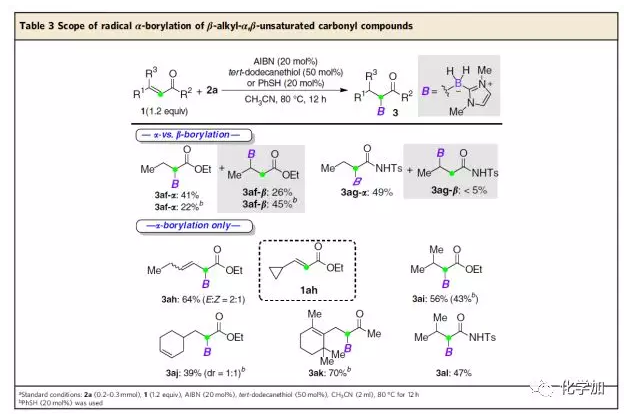
作者認(rèn)為β-芳基可穩(wěn)定烷基自由基,所以β-芳基的存在對該硼氫化反應(yīng)的區(qū)域選擇性起著重要作用。為了證實這個猜想,作者緊接著考察了β-烷基-α,β-不飽和羰基化合物的底物范圍(Table 3)。令人意外的是,巴豆酸乙酯和巴豆酰胺仍能發(fā)生硼氫化反應(yīng),且得到的主產(chǎn)物為α-硼基化物。若使用PhSH作為催化劑,巴豆酸乙酯發(fā)生硼酸化反應(yīng)的主產(chǎn)物變?yōu)?/span>β-硼基化物。值得高興的是,β-環(huán)丙烷取代以及β-位位阻更大的α,β-不飽和羰基化合物只能生成α-硼基化物。
(圖片來源:Nat. Commun.)
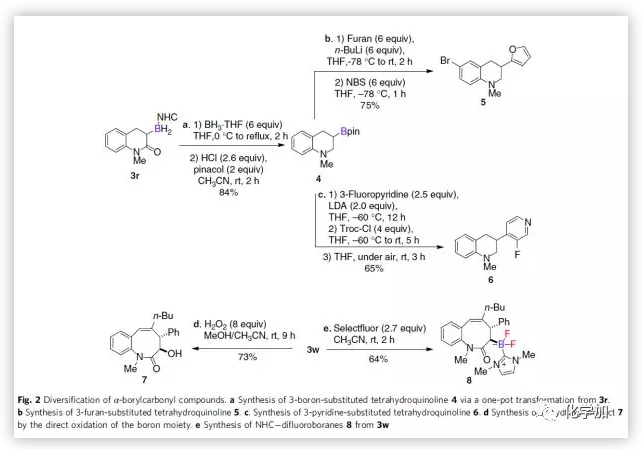
為了證明產(chǎn)物的應(yīng)用潛力,作者又對目標(biāo)產(chǎn)物進(jìn)行了一系列的衍生化反應(yīng)(Fig. 2)。通過還原、偶聯(lián)等一系列反應(yīng),3r可被轉(zhuǎn)化為呋喃-和吡啶-取代的四氫喹啉。此外,8元內(nèi)酰胺產(chǎn)物3w可被轉(zhuǎn)化為α-羥基產(chǎn)物7和更為穩(wěn)定的α-硼基羰基化合物8。
(圖片來源:Nat. Commun.)
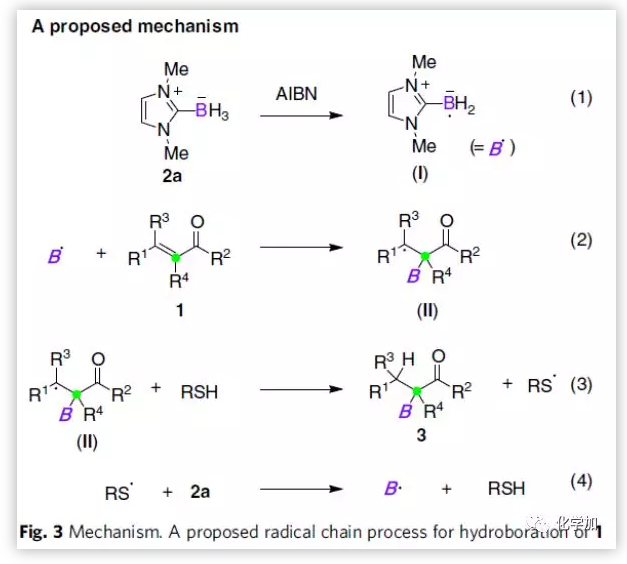
根據(jù)實驗結(jié)果,作者推測可能的機理(Fig. 3):在自由基引發(fā)劑AIBN的作用下,2a被轉(zhuǎn)化為NHC-硼基自由基I。I與α,β-不飽和羰基化合物發(fā)生α-硼氫化反應(yīng),得到烷基自由基中間體II。然后,PhSH催化劑與II發(fā)生氫轉(zhuǎn)移反應(yīng),得到硼氫化產(chǎn)物3和硫自由基。緊接著,硫自由基與2a反應(yīng),生成I和PhSH。再生的I和PhSH參與下一次循環(huán)。為了進(jìn)一步闡明反應(yīng)機制,作者進(jìn)行了密度泛函理論(DFT)研究和動力學(xué)研究,發(fā)現(xiàn)β-芳基-α,β-不飽和羰基化合物能得到α-區(qū)域選擇性產(chǎn)物取決于熱力學(xué)上更有利的自由基α-加成步驟。而β-烷基-α,β-不飽和羰基化合物的α-加成產(chǎn)物則取決于驅(qū)動能量更上有利的氫原子轉(zhuǎn)移步驟。
(圖片來源:Nat. Commun.)
小結(jié):中國科學(xué)技術(shù)大學(xué)周曉國、汪義豐、傅堯團(tuán)隊報道了首例α,β-不飽和羰基化合物的區(qū)域選擇性自由基α-硼氫化反應(yīng)。該方法通過簡單易得的起始原料可以合成各種α-硼基酯、酰胺、酮和酸以及8元內(nèi)酰胺化合物。通過密度泛函理論(DFT)研究和動力學(xué)研究,作者闡明了決定β-芳基-α,β-不飽和羰基化合物和β-烷基-α,β-不飽和羰基化合物區(qū)域選擇性的關(guān)鍵步驟。
撰稿人:暖冬
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點或證實其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn