


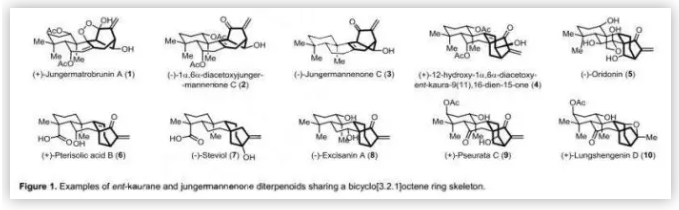
對映-貝殼杉烯二萜類化合物是一類結構復雜的橋連多環天然產物,具有多種生物活性,包括抗癌、抗真菌和抗病毒活性。從生源合成假說可以看出,jungermannenones是對映-貝殼杉烯二萜通過碳正離子重排途徑生成的,其家族成員包括:(+)-jungermatrobrunin A (1)、(-)-1α,6α-diacetoxyjungermannenone C (2)、(-)-jungermannenone C(3)、(+)-12-hydroxy-1α,6α-diacetoxy-ent-kaura-9(11), 16-dien-15-one (4)、(-)-oridonin (5)、(+)-pterisolic acid B (6)、(-)-steviol (7)、(-)-excisanin A(8)、(+)-pseurata C(9)和(+)-lungshengenin D(10)等具有共同的雙環[3.2.1]環結構。幾十年來,其復雜的結構和潛在的生物活性引起了合成化學家們的密切關注。
(+)-jungermatrobrunin A(1)與(-)-2和(+)-4均是由山東大學婁紅祥課題組從地錢(Jungermannia atrobrunnea)中分離得到的,其中(+)-1具有抗真菌活性。從合成的角度來看,(+)-1具有高度氧化的結構以及獨特的雙環[3.2.1]辛烯骨架和過氧橋結構,這暗示其具有潛在的抗瘧作用。近日,北京大學雷曉光課題組通過后期光誘導的骨架重排完成了(+)-1、(-)-2和(+)-4的不對稱全合成,該成果發表在近期Angew. Chem. Int. Ed.上。
(圖片來源:Angew. Chem. Int. Ed.)
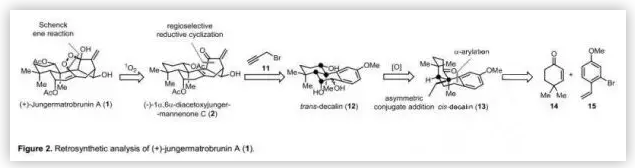
(+)-jungermatrobrunin A(1)的合成策略(Figure 2):由于(+)-1和(-)-2源于同一植物,作者認為(+)-1可以由(-)-2通過仿生光誘導的Schenck-ene反應得到,而(-)-2中擁擠的雙環[3.2.1]辛烯骨架可以由三醇12通過自由基介導的還原環化構建。反式-十氫化萘12可以通過順式-十氫化萘13合成,而后者的三環骨架可以由市售的14和15通過不對稱共軛加成和隨后的α-芳基化快速構建。
(圖片來源:Angew. Chem. Int. Ed.)
具體的合成路線(Scheme 1):首先,作者按Fletcher報道的方法將烯酮14與苯乙烯15進行不對稱共軛加成得到環己酮17(78%,88% ee),重結晶后ee提高至94%,其絕對構型通過單晶X-射線衍射確證。隨后,17經過Pd(II)-NHC(18)催化的分子內α-芳基化、環己酮的區域和非對映選擇性甲基化得到順式-十氫化萘13(64%),然后用Jones試劑對芐位和高芐位進行選擇性雙重氧化得到α-二酮19(81%)。隨后,作者嘗試通過酮-烯醇互變異構化從順式-十氫化萘13合成反式-十氫化萘。首先,作者嘗試了報道的Br?nsted酸或堿性條件,均未能將C6位羰基互變異構成α-酮烯醇20;接下來,作者廣泛篩選了Lewis酸,并發現用CeCl3·7H2O/MeOH處理19后,再用NaBH4還原可以得到α-酮烯醇20。此外,作者以52%的收率得到反式-十氫化萘12,并且為C7位非對映異構體混合物(5.1:1, dr)。最初,12的主要異構體結構通過2D NMR確定;隨后,作者通過其衍生物二醇21的單晶X-射線衍射確證。十氫化萘12經Birch還原和甲基烯醇醚的酸水解得到二烯酮22,然后經四步轉化(二醇的TMS保護、立體選擇性α-炔丙基化、二烯酮的Luche還原和雙烯丙基醇的MOM保護)以32%的總收率得到二烯炔23。在得到二烯炔23后,作者嘗試用1,6-二烯環化構建具有挑戰性的雙環[3.2.1]辛烯骨架。首先,作者用HSn(Bu)3處理23得到jungermanneone-型骨架24作為單一產物,然后經外式亞甲基的原位氧化裂解以61%的收率得到酮25(克級規模收率為48%)。接下來,作者用Sc(OTf)3/Ac2O處理25,其TMS和MOM保護基均被Ac替換生成三乙酸酯26,最后經原位α-亞甲基化和(堿性條件下)選擇性脫除C12位保護基以67%的收率得到(-)-2。

(圖片來源:Angew. Chem. Int. Ed.)
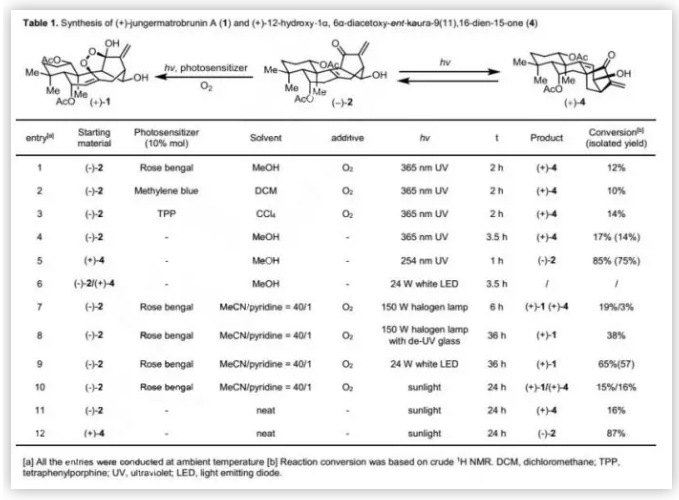
完成(-)-2的全合成后,作者將注意力轉向光誘導單線態氧的Schenck-ene反應以構建(+)-1的過氧橋。然而,當(-)-2暴露于紫外光(365 nm)時,即使在O2和光敏劑存在下,未觀察到(+)-1,反而是觀察到了唯一產物(+)-4。隨后,作者用365 nm紫外線照射(-)-2的甲醇溶液僅以14%的分離收率得到(+)-4,其中81%的(-)-2得到回收。無法實現(-)-2到(+)-4的完全轉化,表明(-)-2與(+)-4之間的轉化存在平衡。作者用實驗證實了這一假設:用UV(254 nm)照射(+)-4時,以75%的分離收率得到(-)-2,并認為對映-貝殼杉烯至jungermannenone骨架重排可能通過光誘導的β,γ-不飽和酮的1,3-酰基遷移進行。
(圖片來源:Angew. Chem. Int. Ed.)
接下來,作者對Schenck-ene反應的條件進行了廣泛篩選(Table 1),并發現用150 W鹵燈和玫瑰紅在共溶劑(甲醇/吡啶=40/1)中可以19%的轉化率得到(+)-1和3%的轉化率得到重排產物(+)-4。考慮到紫外、可見光在內的鹵燈的光譜范圍很寬,作者猜測紫外光誘導的重排可能影響Schenck-ene反應。當用鹵燈配備紫外光過濾器時,可以38%的轉化率得到單一產物(+)-1;進一步優化發現,當用24 W白光LED燈照射(-)-2時,可以57%的分離收率(65%轉化率)得到單一產物(+)-1。實驗表明,可見光對雙環[3.2.1]辛烯重排沒有任何影響。總之,上述研究表明,可見光有利于Schenck-ene反應,而紫外光有利于雙環[3.2.1]辛烯重排。
由于(+)-1、(-)-2和(+)-4均是從地錢Jungermannia atrobrunnea中分離得到;同時,陽光(包含紫外光和可見光)是最常見的光源。因此,作者認為(+)-1和(+)-4可能均是衍生自(-)-2。為了進一步探索其生源關系,作者在光照下進行了光誘導的反應。當(-)-2在先前的反應條件下暴露于陽光時,得到(+)-1和(+)-4的混合物;當(-)-2或(+)-4在純凈條件下暴露于陽光時,光誘導的骨架重排轉化率分別為16%和87%。
小結:北京大學雷曉光課題組通過雙環[3.2.1]-辛烯環的多樣性光誘導骨架重排經過12-13步完成了(+)-jungermatrobrunin A(1)、(-)-2和(+)-4首次不對稱全合成。通過光化學研究發現,紫外光有利于雙環[3.2.1]辛烯重排得到(+)-4,而可見光有利于Schenck-ene反應得到(+)-1。此外,作者通過研究表明光化學反應也可能發生在對映-貝殼杉烯二萜類化合物的生物合成中,并認為光誘導的1,3-酰基遷移在天然產物合成中將具有更廣泛的應用。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn