

結核病(TB)是由結核分枝桿菌引起的一種傳染病,是世界上主要的空氣傳播病原體之一。多重耐藥結核病和廣泛耐藥結核病的發展和傳播對全球公共衛生造成了顯著威脅,因此,新的結核病化療藥物,特別是針對多重耐藥結核病和廣泛耐藥結核病的化療藥物,有著極大的社會需求。Rodriguez等人從加勒比海牛鞭草中分離出了Pseudopteroxazole (1)和Ileabethoxazole (2)兩種海洋苯并噁唑生物堿,1和2對結核分枝桿菌均有明顯的抗菌活性。它們在抗結核藥物開發上的潛力引起了有機合成化學家們的廣泛關注。Corey等人用立體控制的陽離子環化過程實現了1的首例全合成和結構修定;Harmata等人通過苯并噻嗪化學合成了1;羅佗平等人基于環己烯酮的不對稱共軛加成和立體選擇性Cope重排,開發了一種針對1和其他天然產物的多樣性和對映選擇性合成方法;Williams等人通過鐵介導的[2+2+1]碳環化實現了2的第一次全合成;李昂等人采用電環化/芳構化策略,完成了1,2和seco-pseudopteroxazole的集群式的全合成。近日,西北大學化學院胡向東教授課題組提出了一種新的對映選擇性方法合成了1和2,相關成果發表在Angew上(DOI:10.1002/anie.201901651)。
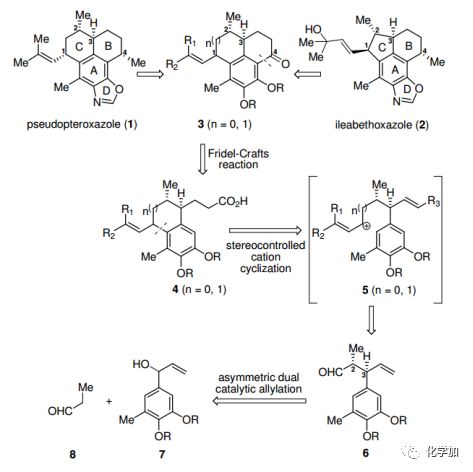
圖1. 目標分子結構及其逆合成分析(圖片來源:Angew. Chem. Int. Ed.)
在結構上,1和2具有相同的A/B/D環系,在C2、C3和C4上具有相同的立體構型,不同之處在于C1上的取代基和構型以及C環的大小。考慮到Carreira課題組開發的不對稱雙催化烯丙基化反應有望可靠地引入醛6中的兩個起始的手性中心(C2和C3),而且不對稱雙催化烯丙基化反應通過銥和胺催化的不同組合,可以促進四種立體異構體的合成,具有優良的對映選擇性和良好的非對映選擇性。因此,用該方法可以在1和2的C2和C3處得到非對映異構體。C環的形成,挑戰是在1和2中的C1上構造相反的手性中心。Corey等人開發的立體控制陽離子環化反應是解決類似問題的有效方法。芳香環上具有不同電性的取代基可以通過不同的途徑誘導陽離子環化,在C1上生成立體化學相反的產物。在此,作者設想,中間體5的陽離子環化也可能實現立體控制,并在1和2中為C1上兩種相反的立體化學提供可靠的途徑。在此基礎上,采用分子內傅克反應生成環B。最后,C4羰基轉化成甲基并引入噁唑環,分別完成1和2的全合成。
已知醛9與乙烯基溴化鎂發生格氏反應,得到烯丙醇7。和丙醛8反應時,根據Carreira的不對稱雙催化烯丙基化反應,將[Ir/(S)-10]和(S)-11結合,在6中引入兩種預期的立體化學。使用F2CHCO2H作為促進劑,能以10:1的非對映選擇性和83%的產率得到6,并具有優秀的對映選擇性(94%ee)。
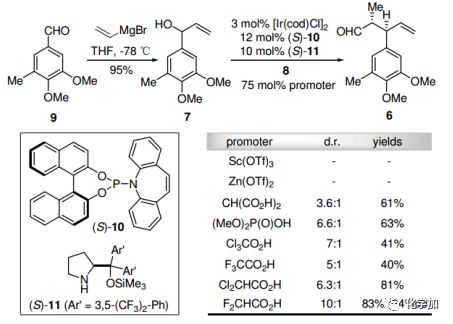
圖2. 不對稱雙催化的烯丙基化反應條件篩選(圖片來源:Angew. Chem. Int. Ed.)
醛6通過Wittig-Vedejs E-選擇性烯烴化得到13,在甲磺酸作用下,13能以優秀的產率和非對映選擇性發生陽離子環化反應得到14。值得注意的是,甲苯和DCM的共溶劑對非對映選擇性至關重要。14的硼氫化-氧化反應得到醇15,產率72%,并經X-射線晶體衍射,確證了14中C1、C2和C3上的相對構型。在Hoveyda?Grubbs二代催化劑條件下,14和丙烯酸甲酯發生烯烴交叉復分解反應,然后進行Ni-催化的共軛還原,以優秀的產率得到化合物17。17皂化后得到羧酸18,經三氟乙酸酐處理,發生分子內傅克反應得到酮19。甲基鋰親核進攻19的酮羰基并用Et3SiH/TFA脫羥基,得到化合物21。將21的兩個甲氧基保護脫除,隨后用Kerr的方法引入噁唑環,就完成了(+)-Pseudopteroxazole (1)的全合成,其具有與天然產物相同的光譜數據和物理性質。
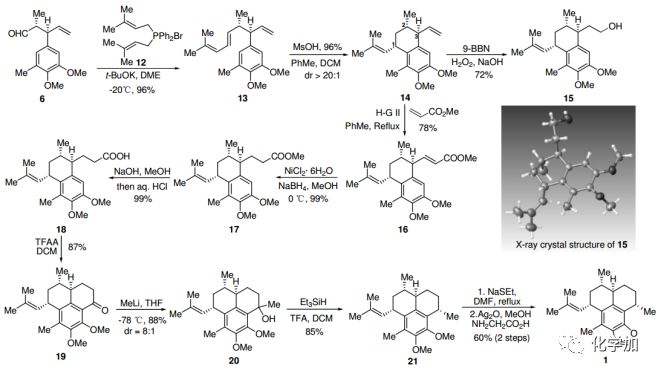
圖3. Pseudopteroxazole (1)的合成路線(圖片來源:Angew. Chem. Int. Ed.)
根據相同的策略,6和丙烯酸甲酯進行烯烴交叉復分解,然后乙烯基溴化鎂親核加成,生成醇23和24,比例為1:2.5。據Felkin-Anh模型,主要產物應為24。在BF3-Et2O條件下,24順利進行環化反應,以約7:1的非對映異構體比例得到25。值得注意的是,在相同的條件下,23的環化也能形成25及其非對映異構體,比例為3:1。使用CuBr·Me2S/Red-Al對 α,β-不飽和酯25進行共軛還原,以90%的產率得到26。26皂化后發生傅克反應,得到酮27,構建了環B。C4中的甲基通過相同的程序——甲基化和脫羥基得到,得到單一產物29。
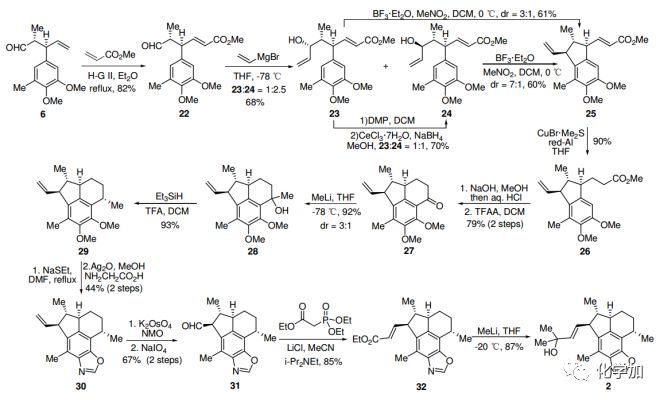
圖4. Ileabethoxazole (2)的合成路線(圖片來源:Angew. Chem. Int. Ed.)
繼續采用Kerr方法引入噁唑環,兩步產率44%,得到化合物30。30的末端雙鍵二羥基化,隨后氧化裂解形成醛31。31發生HWE反應得到α,β-不飽和酯32,經過量的甲基鋰處理后,最終合成了(+)-Ileabethoxazole (2),其光譜數據和物理性質與報道的一致。
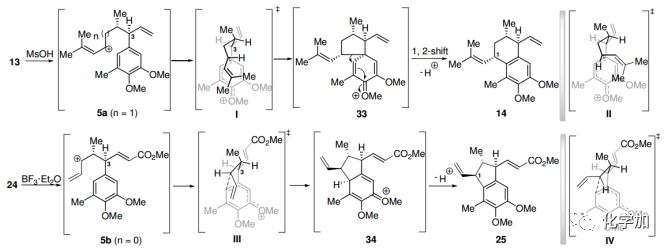
圖5. 13和24的環化機理(圖片來源:Angew. Chem. Int. Ed.)
雖然1和2的對映選擇性全合成已經完成,但13和24的陽離子環化在14和25的C1上引入相反的構型,非常有趣,值得研究。為此,作者提出了如圖5所示的一種立體化學控制的機制。對于13的陽離子環化反應,首先要通過甲磺酸的質子化生成中間體5a。接下來的過程可能受到三個因素的影響,第一種是C3取代基與芳香環之間的A1’3-相互作用,它傾向于氫在過渡態I和II 中,C3上的氫和芳香環共平面的構象。其次,根據Corey等人對這類陽離子環化的探索,在過渡態I和II中,宜采用螺五元環關環方式。第三,芳香環與異丁烯基之間的π-π相互作用將促進過渡態I的形成,從而導致螺中間體33的生成。33的1,2-遷移生成14,因此,π-π相互作用在C1的立體選擇性中占主要地位。在24的環化反應中,相同的A1’3-相互作用將傾向于在過渡態III和IV中,C3上的氫和芳香環共平面的構象。芳環與過渡態乙烯基之間的π-π相互作用將通過并五元環模型促進中間體34的生成,最終形成25。值得注意的是,24的環化比23具有更好的立體選擇性。這是因為羥基在24中的離去會直接導致過渡態Ⅲ的形成,因為C1的構型允許芳香環從羥基的背面進攻。在B3LYP/6-31g*水平上,用密度泛函理論(DFT)方法對該機理進行了計算,結果表明,π-π相互作用對13和24環化的非對映選擇性起著重要作用。
總結:西北大學胡向東教授課題組完成了Pseudopteroxazole(1)和Ileabethoxazole (2)的不對稱全合成。整條路線簡潔高效,其關鍵步驟包括:通過Carreira的不對稱雙催化烯丙基化反應,在中間體6中構建了兩個起始手性中心;13和24的陽離子環化提供了一種有效的途徑,在1和2的C1上構建了相反的構型,這可能是通過π-π相互作用來控制陽離子環化的新版本。這條路線還具有立體選擇多樣性和結構多樣性的特點,對系統研究該類天然產物的合成和生物活性具有重要意義。
撰稿人:詩路化語
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn