

吡啶衍生物是許多藥物及生物活性分子中非常重要的結構單元,是美國FDA批準的藥物中包含最多的氮雜芳環,因此關于吡啶環系的構筑和修飾具有十分重要的研究意義。目前報導的關于吡啶直接C-H鍵官能團化的方法還僅限于獲得消旋的產物,關于對映選擇性C-H鍵活化的報導很少,而且均是在2-位。日本理化所侯召民等人發展了Sc-催化的吡啶6-位C-H鍵的烷基化,但是吡啶3-位或4-位的不對稱的C-H鍵活化還未曾有過報導。
5,6,7,8-四氫喹啉(THQ)及5,6,7,8-四氫異喹啉(THIQ)衍生物是藥物分子中非常常見的結構。

Figure 1. 含有吡啶環的藥物分子及天然產物(圖片來源:J. Am. Chem. Soc.)
目前已經發展了很多合成THQs及THIQs的方法,但是對映選擇性的獲取該類手性分子的方法幾乎沒有報道。目前獲取該類化合物的方式主要是通過吡啶類似物的氫化,但是對于高度穩定的芳香體系的選擇性氫化是很難實現的。Kuwano等人能夠以82%的ee值合成5,6,7,8-THQs 及 -THIQs,這是目前報道的最高水平。本文作者開發了一種利用鎳催化劑催化與吡啶連接的烯烴來實現吡啶區域選擇性、立體選擇性的官能團化,高效的合成了光學活性的THQs及THIQs (Scheme 1)。使用該體系,作者提出仍然需要面臨三個強大的挑戰:1.在Ni-催化的條件下,烯烴底物很容易發生異構化,必須抑制這一過程的發生;2.烯烴及吡啶完全的位點控制十分困難;3. Ni-催化的C-H鍵的官能團化目前鮮有報道,Ni對于配體及底物十分敏感,會極大的限制配體及底物范圍。
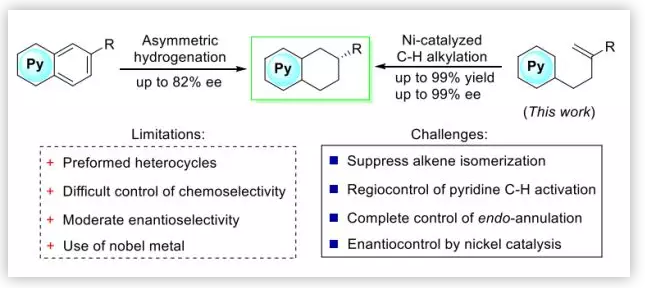
Scheme 1. 5,6,7,8-THQs及5,6,7,8-THIQs不對稱合成方法(圖片來源:J. Am. Chem. Soc.)
作者之前發展了一些N-雜環卡賓配體(NHCs),如SIPE和ANIPE,并成功實現了首例Ni-催化的炔烴對醇的不對稱的烯基化反應,作者將此體系應用到吡啶的C-H鍵活化中去,來實現THQs及THIQs手性合成。
反應條件優化:作者受Nakao 及 Hiyama 等人在Ni-Al催化劑方面的工作以及Cramer及葉萌春等人在N-雜環不對稱C-H鍵活化方面工作的啟發,使用連有烯烴的吡啶1a作為模型底物,在Ni(cod)2存在下,使用含Al的Lewis酸及手性配體。作者最開始使用常見的手性膦配體及NHC配體,無法得到目標產物2a。使用配體L1并額外添加大位阻化合物MAD,可以以幾乎當量的產率及72% ee值獲得2a (Table 1, entry 1),而且沒有觀察到任何發生在吡啶2-位環化及烯烴移位的產物。作者推測主要是MAD通過Al-N配位,利用其大位阻屏蔽了2-位的反應位點。關于烯烴,作者認為與Ni配位的大位阻配體導致發生了反馬氏規則的芳氫化。作者嘗試使用更大位阻配體L2,L3,對映選擇性不斷提高(entries 2-3)。使用作者之前開發的SIPE類型的配體,對映選擇性明顯提高(entries 4-6)。使用不飽和的NHC L7配體,產率及對映選擇性均明顯下降(entry 7)。此外,作者嘗試了其它Lewis酸AlMe3 及 AlEt3 均沒有MAD效果好(entries 8-9)。控制實驗證明Ni、MAD、NHCs對于該反應均是至關重要的(entries 10-12)。
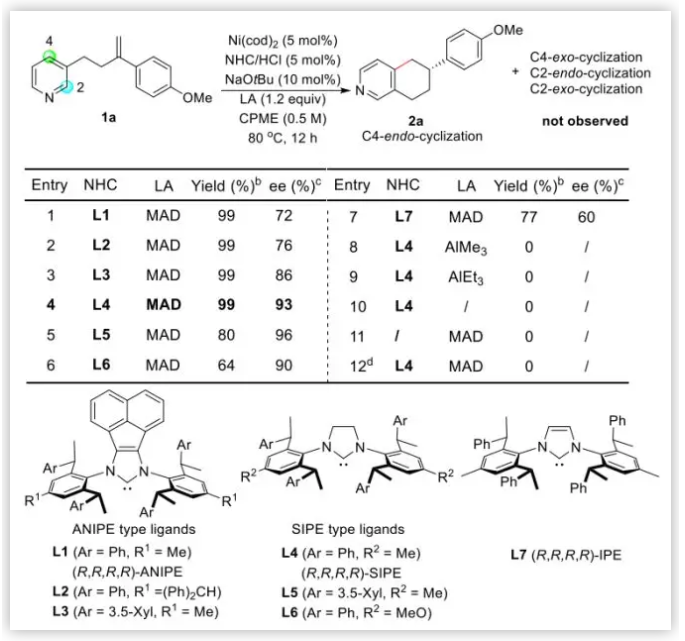
Table 1. 反應條件優化(圖片來源:J. Am. Chem. Soc.)
底物拓展:作者以與吡啶3-位相連的烯烴進行底物拓展(Table 2),均可以以完全的區域選擇性,中等到優秀的收率及非常好的立體選擇性獲5,6,7,8-THIQs。烯烴上取代基的立體效應對于反應的影響很小,2c-2f,2q均能以良好的收率及立體選擇性獲得。苯乙烯類型的底物無論苯環上連有供電子取代基(1a,1g,1i,1j,1k)還是弱吸電子取代基(1h),反應均能很好進行。如酰胺這種可以提供質子的底物可以獲得很高的收率及極好的對映選擇性,但是酯類底物如1m產率很低而且會發生烯烴的異構化。一些含有雜環的底物如1k,1n,1o,1x,1y均能兼容。除了1,1,二取代烯烴及苯乙烯類底物外,三取代烯烴(1v)及烯胺均能以較高的收率及極好的對映選擇性獲得產物。五元并環的吡啶依然能夠獲得(2w)。作者也嘗試了吡啶環含有取代基的底物,同樣能夠兼容(1r,1s)作者隨后以與吡啶2-位相連的烯烴進行了底物拓展,無論是1,1二取代烯烴類的底物(3a-3f),還是吡啶環上不同取代基的底物(3g,3h)均有良好的收率及立體選擇性。作者使用與吡啶4-位相連的烯烴作為底物(5a),反應仍能順利進行。最后作者以底物1c進行克級規模反應,可以以很高的產率及對映選擇性獲得產物2c。
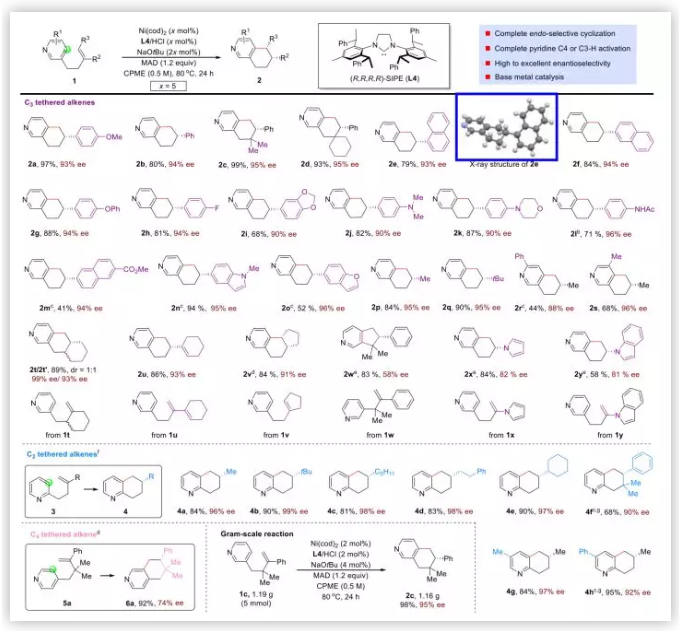
Table 2. 底物拓展(圖片來源:J. Am. Chem. Soc.)
機理研究:首先,作者使用d-3a(96% D)作為底物進行反應,最終有92%D整合到烯烴的內部位置(Scheme 2A)。動力學同位素效應(KIE=2.5)表明C-H鍵斷裂可能是決速步。有趣的是,作者使用底物3a在正辛烯存在下進行反應,幾乎沒有目標產物4a產生,而是獲得了吡啶對位C-H鍵烷基化產物7,這表明對位的C-H鍵氧化加成可能是可逆且很快的(Scheme 2C)。此外,作者使用兩種不同底物進行競爭實驗,沒有發生同位素的亂置現象(Scheme 2D)。
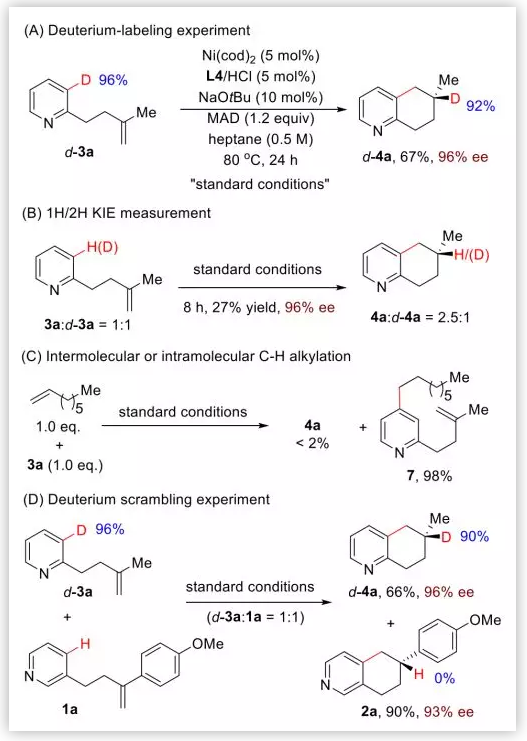
Scheme 2. 機理驗證試驗(圖片來源:J. Am. Chem. Soc.)
基于以上實驗結果,作者推測了反應的催化循環(Scheme 2E):(1)首先,大位阻的MAD與吡啶的N配位,擠壓烯烴與Ni靠近發生配位;(2)隨后,Ni發生C-D鍵的氧化加成;(3)然后,反馬式的烯烴插入形成7元環;(4)最后,還原消除產生最終產物,催化劑再生。
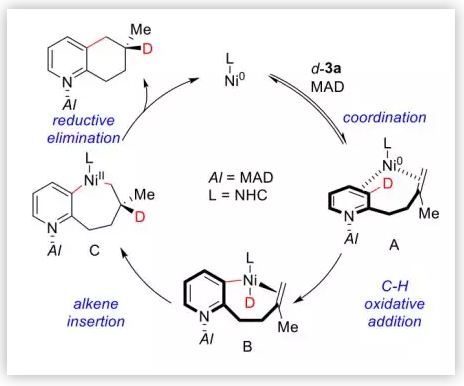
Scheme 2E. 推測的可能的催化循環(圖片來源:J. Am. Chem. Soc.)
小結:上海有機所施世良課題組發展了第一例吡啶的不對稱C-H鍵環化的方法,通過使用與吡啶相連的烯烴為底物,在Ni催化劑及手性NHC配體催化下,實現了吡啶3,4-位的C-H鍵的不對稱烷基化。該方法為5,6,7,8-THQs 及 5,6,7,8-THIQs類化合物的獲取提供了一種高效的方式,同時也拓展了Ni-NHC催化劑的應用范圍。
撰稿人:超級瑪麗
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn