

手性胺是光學活性物質、藥物分子和配體等多功能手性分子中的重要結構單元(Scheme 1)。在手性胺的諸多合成策略中,亞胺的不對稱催化氫化已成為最實用和最有效的方法之一。在過去的幾十年中,基于Rh,Ru,Ir和Pd等過渡金屬的催化劑已廣泛用于各種亞胺的不對稱氫化,且反應產率良好,但由于過渡金屬昂貴的價格,大大限制了其廣泛應用。所以,有機合成化學家更加關注于開發價格低廉的過渡金屬催化劑,盡管這些過渡金屬催化劑具有優異的對映選擇性和產率,但仍存在明顯的不足,特別是在催化效率上,所報道的文獻中,底物與催化劑的質量比值(S/C)大都小于1000,這也大大限制了它們在工業規模的不對稱催化氫化中的應用。因此開發高效低廉的不對稱氫化催化劑顯得十分重要。

(圖片來源:Angew. Chem. Int. Ed.)
首先,作者以(E)-2-甲基-N-(1-苯基亞乙基)丙烷-2-磺酰胺(1a)作為標準底物,在H2(50 bar),50 ℃和三氟乙醇(TFE)的反應條件下,考察了許多手性二膦配體(Table 1)。可以看出,當使用軸向手性配體(S)-BINAP和(S)-SegPhos時,其具有中等催化效率和低對映選擇性,與(S)-SegPhos相比,含有高度取代苯環的(S)-DTBM-SegPhos顯示出更優異的催化活性和對映選擇性,富電子的配體(Rc,Sp)-DuanPhos具有99%的轉化率但ee值僅為78%。而(R,R)-QuinoxP*作為配體時,反應能以99%的產率和97%ee值生成相應產物。

(圖片來源:Angew. Chem. Int. Ed.)
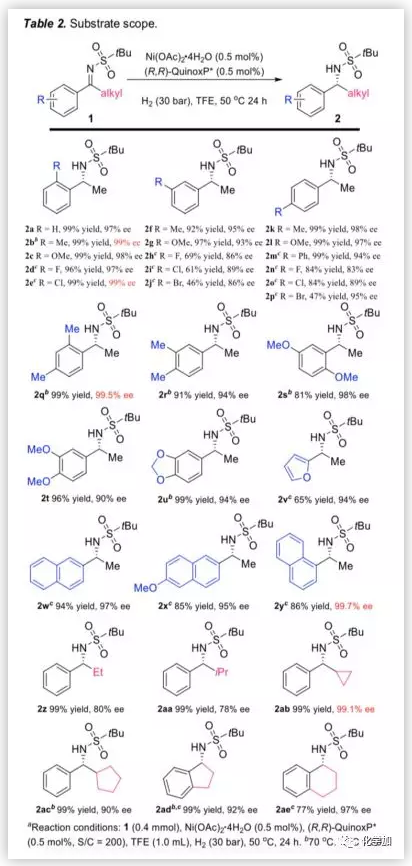
基于最優反應條件,作者對亞胺底物的適用范圍進行了考察(Table 2)。結果表明,當給電子取代基或吸電子取代基存在于2-,3-或4-位時(2b -p),反應均能以中等到優異的產率和對映選擇性得到相應產物。此外,無論是二取代底物,苯并環底物還是呋喃基或萘基取代的底物,均能以良好至優異的對映選擇性得到產物(2v-y,1ad,1ae)。接著,作者考察了帶有不同烷基的底物,當甲基被乙基、異丙基、環丙基或環戊基等烷基取代時,反應也能以高轉化率和優異的對映選擇性得到相應產物(2z-ac)。
(圖片來源:Angew. Chem. Int. Ed.)
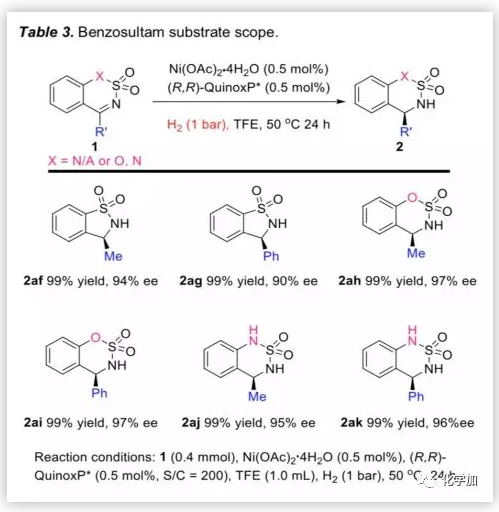
為了進一步擴展底物的適用范圍,作者考察了帶有甲基或苯基的環狀N-磺酰亞胺底物(Table 3)。在H2(1 bar)和0.5 mol%催化劑負載量的條件下,無論是五元環狀底物還是含氧或氮的六元環狀底物,反應均能以優異的產率和ee值生成相應產物。
(圖片來源:Angew. Chem. Int. Ed.)
然后,作者用AlCl3脫除2a和2g的tBu-磺酰基,以優異的產率分別得到手性胺3a和3g,且沒有ee值損失(Scheme 2),這些手性胺可進一步轉化為各種手性藥物和生物活性化合物,如Fendiline(芬地林),IDH1抑制劑,NPS R568和Rivastigmine(卡巴拉汀)等。

(圖片來源:Angew. Chem. Int. Ed.)
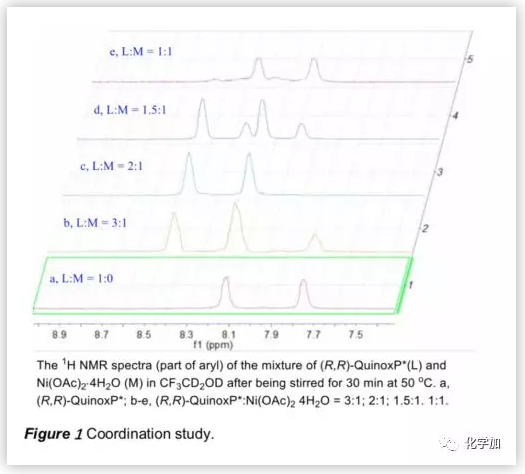
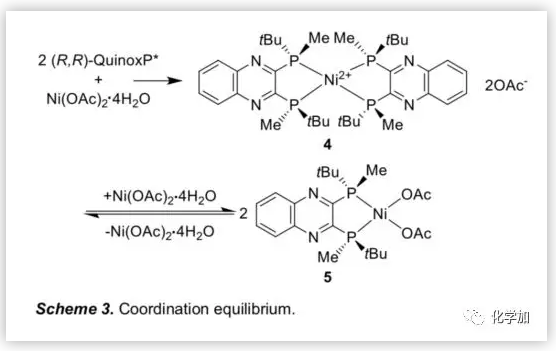
接下來,作者利用1H NMR研究了(R,R)-QuinoxP*與Ni(OAc)2.4H2O在d3-TFE中的配位行為(Figure 1)。結果表明,Ni鹽與其配合物之間存在配位平衡,以2/1和1/1的比例(配體/Ni鹽)形成的主要配合物分別為4和5(Scheme 3)。
根據上述配位行為,作者研究了Ni(OAc)2.4H2O與(R,R)-QuinoxP*的配位比例變化對不對稱氫化的影響。結果表明,過量的Ni鹽能夠促進活性Ni配合物5的形成,從而提高氫化效率。
(圖片來源:Angew. Chem. Int. Ed.)
(圖片來源:Angew. Chem. Int. Ed.)
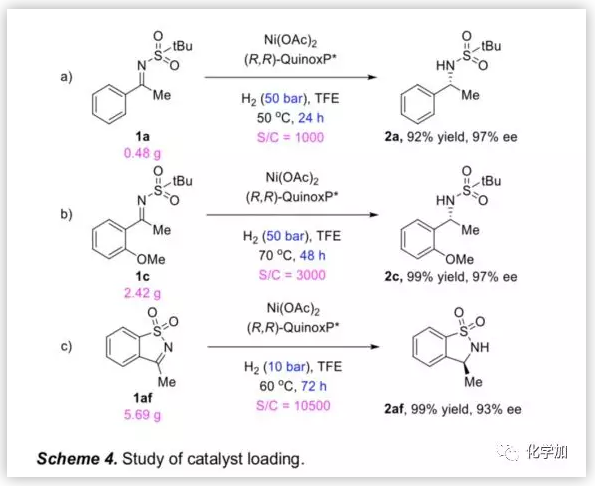
為了考察反應體系的催化效率,作者研究了底物1a,1c及1af在低催化劑負載量,無水Ni(OAc)2 及20/1(Ni鹽與配體)的條件下的氫化。1a在S/C=1000條件下,以92%的產率和97%的ee值得到產物(Scheme 4a)。在S/C=3000的條件下反應48 h,1c以97%ee值完全轉化成相應產物(Scheme 4b)。而在低催化劑負載量(0.0095 mol%,S/C = 10500)的存在下,環狀底物1af實現了完全氫化,且以93%ee值得到產物2af(Scheme 4c)。結果表明,該反應在低催化劑負載量的條件下可高效催化反應。
(圖片來源:Angew. Chem. Int. Ed.)
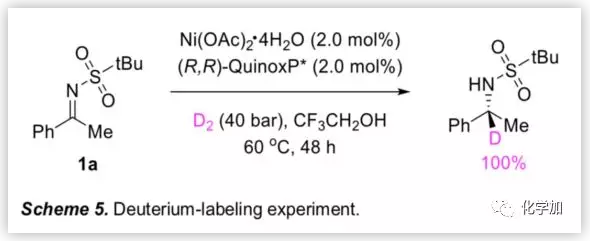
為了研究不對稱氫化的反應機理,作者進行了氘代實驗,在40 bar的D2條件下,結果顯示氘添加到前手性碳上(Scheme 5)。該結果表明,Ni-催化的反應機理類似于Pd-催化亞胺不對稱氫化的反應機理。
(圖片來源:Angew. Chem. Int. Ed.)
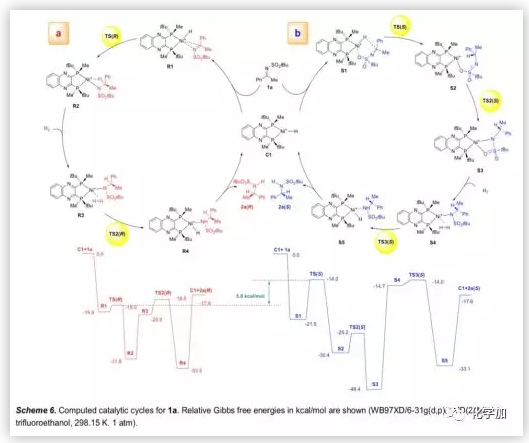
基于氘代實驗,作者用C1作為活性催化劑,計算并研究了1a氫化的催化循環機理的可行性(Scheme 6)。首先,催化劑C1通過其前手性平面與底物1a配位形成R1或S1,R1中的Ni-H和C=N鍵的共面取向有利于氫化物轉移,而含有六元環的S1比R1稍微穩定,但其反應活性顯著降低。由于TS(R)中穩定的分子內相互作用,導致競爭性過渡態TS(R)和TS(S)之間存在5.0 kcal/mol的自由能差異。此外,TS(R)中催化劑和底物之間的弱吸引相互作用也有助于催化活性。
(圖片來源:Angew. Chem. Int. Ed.)
總結:上海交通大學張萬斌教授課題組開發了Ni-催化N-磺酰亞胺不對稱氫化的合成新策略,為合成手性胺提供了新途徑。該反應具有高催化效率(S/C高達10500)和優異的對映選擇性且底物適用范圍廣,極大地推動了不對稱氫化的快速發展。
撰稿人:Effie小迷弟
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn