

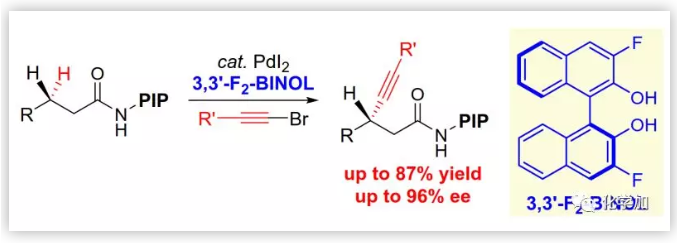
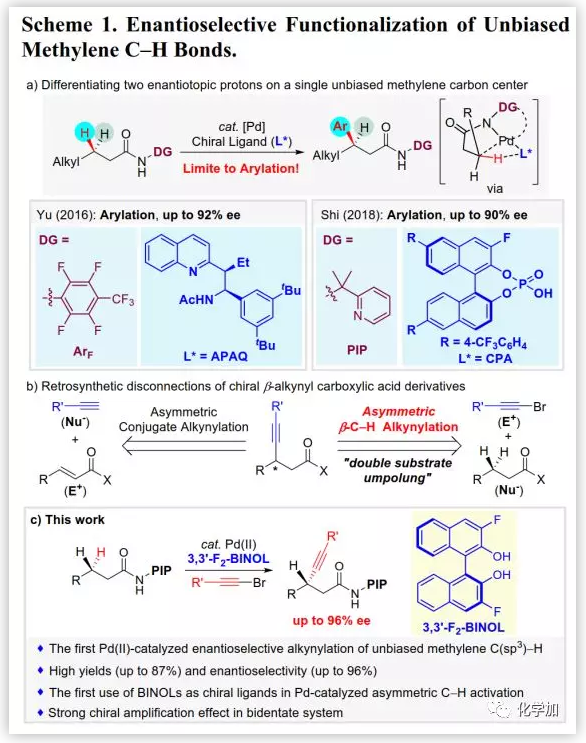
C(sp3)-H鍵的不對稱官能團化是構建含復雜手性中心化學分子的有效合成工具,激發了許多涉及高反應性金屬卡賓和金屬氮賓中間體的立體選擇性C-H插入反應的發展。由于手性環鈀化中間體可以轉化為各種有用的官能團,通過金屬插入的Pd-催化不對稱脂肪族C-H活化反應受到了廣泛關注。不對稱C-H活化的關鍵是發現合適的手性配體以同時調控反應性和立體化學,其中余金權、Kagan、Kündig、Baudoin、Cramer和Gaunt等人在這方面做出了突出貢獻。然而,關于亞甲基C(sp3)-H鍵的不對稱官能團化的研究相對較少。2016年,余金權課題組通過弱配位單齒導向基團與二萜酸乙酰基保護的氨基乙基喹諾酮(APAQ)的配體組合實現了無偏亞甲基C(sp3)-H的不對稱芳基化(Scheme 1a)。2018年,浙江大學史炳鋒課題組報道了通過其發展的PIP雙齒導向基團,在6,6'-位修飾的BINOL磷酸配體的參與下實現了Pd(II)-催化的無偏亞甲基C(sp3)-H鍵的不對稱芳基化。
構建不對稱β-炔基羧酸及其衍生物非常重要,目前通過α,β-不飽和羰基化合物的不對稱共軛炔化是其主要構建策略。然而,由于脂肪酸在自然界普遍存在,脂肪族β-C(sp3)-H鍵的不對稱炔化為其提供了一種替代策略。另外,與常規共軛加成(Scheme 1b)相比,這種互補的C-H活化策略也代表了某種雙重底物極性反轉。2011年,Chatani課題組首次報道了由8-氨基喹啉介導Pd(II)-催化的脂肪族羧酸衍生物中亞甲基C(sp3)-H鍵的炔化反應,然而,不對稱炔化的開發更具挑戰性并且尚未成功。
在前期芳基化研究中,作者認為其成功的關鍵是PIP的偕二甲基與單齒CPA配體骨架之間的空間位阻可以限制旋轉從而誘導良好的立體控制,而亞甲基C-H炔化與該催化體系不相容。因此,作者著手開發一種新型的手性配體以有效的立體控制,基于前期對雙齒配體/Pd(II)-催化的不對稱C-H芳基化的研究,作者認為軸手性聯萘骨架可能是實現不對稱C(sp3)-H活化的特殊骨架。近日,史炳鋒課題組首次開發了一種以BINOL 衍生物作為手性配體的Pd(II)-催化的亞甲基C(sp3)-H鍵的對映選擇性炔化方法(Scheme 1c),該成果發表在近期J. Am. Chem. Soc.上(DOI:10.1021/jacs.9b01124)。
(圖片來源:J. Am. Chem. Soc.)
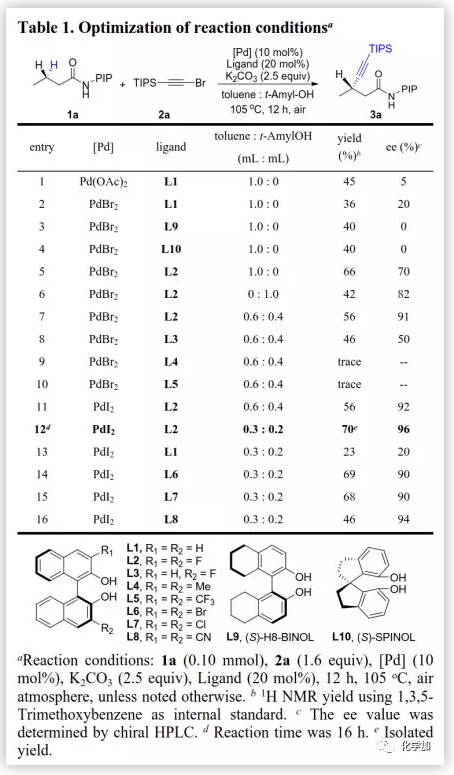
首先,作者以丁酰胺(1a)和1-溴-2-(三異丙基甲硅烷基)乙炔(2a)為底物、(S)-BINOL為手性配體研究了反應(Table 1),以45%的產率得到β-炔化產物3a(5% ee);當用PdBr2作催化劑時,ee值(20%)顯著提高;當用(S)-H8-BINOL (L9)和(S)-SPINOL (L10)時,得到外消旋產物。由于3,3'-二氟-CPA在C-H芳基化反應中可以顯著提高對映選擇性,作者嘗試在BINOL的3,3'-位引入氟,結果顯示3,3’-二氟-BINOL (L2)增強了反應性和立體控制(66%, 70% ee)。當用叔戊醇作溶劑時,以82%的ee值得到3a,但產率降低;當用甲苯和叔戊醇(0.6 mL:0.4 mL)混合溶劑時,ee值增加至91%。此外,作者還測試了在3,3'-位具有其他取代基的BINOL配體,但均導致反應性和選擇性降低。當用PdI2作為催化劑時,ee值略微提高。作者還進一步優化了濃度和反應時間,并在高濃度下以70%的分離產率得到3a(96%ee)。在優化的條件下,通過重新測試(S)-BINOL (L1)的效果(23%, 20% ee)進一步證明了二氟在3,3'-位的重要性。隨后,作者還研究了在3,3'-位引入其他吸電子基團(如Br,Cl,CN)的BINOL配體,與L1相比,均可以顯著提高反應性和選擇性,其中L2最佳。雖然氟的確切影響尚不清楚,但作者認為3,3'-位的雙氟可以增加BINOL的酸性以改善催化劑反應性,同時保持最小的空間位阻。
(圖片來源:J. Am. Chem. Soc.)
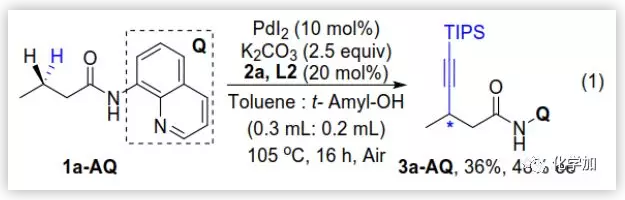
最后,作者還在優化的條件下評估了8-氨基喹啉導向基團的作用,然而炔化產物的產率和選擇性均降低(36%,48%ee)。
(圖片來源:J. Am. Chem. Soc.)
在得到優化的反應條件后,作者考察了脂肪族酰胺的適用范圍(Table 2)。含有各種直鏈的脂族族酰胺均可以良好的產率和對映選擇性(92-96%ee)得到相應的產物;在遠端位置具有位阻基團的脂肪族酰胺、含有N-Me-吲哚的脂肪族酰胺、含有雙鍵的油酸衍生物以及苯基丙酰胺也具有良好的耐受性;在芳環鄰位含有甲基的底物也可以良好的產率(64%)和優秀的選擇性(94%ee)得到炔化產物。在芳環對位含有各種取代基如鹵素、甲基和硝基的底物也可以優異的對映選擇性(94-96%ee)得到相應產物。
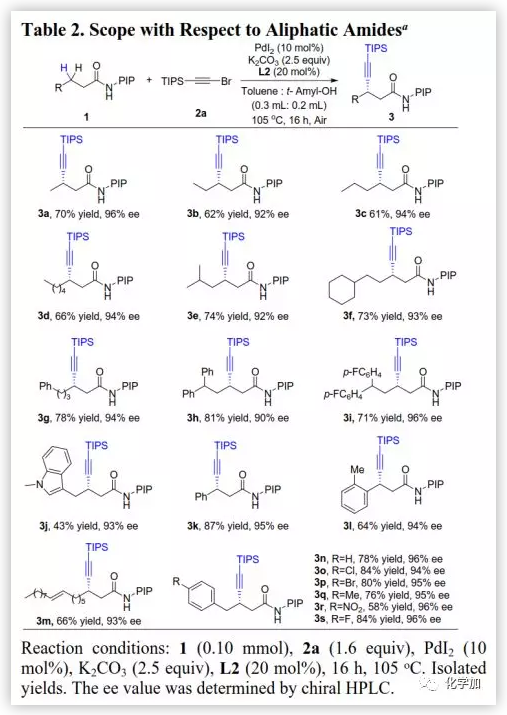
(圖片來源:J. Am. Chem. Soc.)
接下來,作者進一步考察了溴化炔的適用范圍(Table 3)。TIPS被位阻小的TES取代的底物反應可產生較好的產率和選擇性(4a,59%,93%ee),而由相應的酮制備的炔丙基甲硅醚(2b和2c)的選擇性略低(4b和4c,88%ee)。含有芳環(2d-e)的炔丙基甲硅醚也是合適的偶聯配偶體,產物具有優秀的對映選擇性(90-94%ee),其絕對構型通過4d的X-射線衍射確證。

(圖片來源:J. Am. Chem. Soc.)
為了了解其反應機理,作者進行了一系列實驗(Figure 1)。首先,研究了不同鈀催化劑在是否含有L2條件下的催化效果。條件i(Pd(OAc)2, no ligand)下的反應初始速率略快于條件ii(Pd(OAc)2+L2)下的反應速率,但用配體L2可以提高催化活性和產率(Figure 1a, 38% vs 63%)。當PdI2用作催化劑時,反應顯著加速;條件iv(PdI2, no ligand)僅以7%的產率得到3a(iv),而條件iii(PdI2+ L2)可以71%的產率得到3a。以上結果表明,當用PdI2作催化劑時,無配體的對照反應明顯慢于有配體輔助的反應,并且PdI2的對映體控制性比Pd(OAc)2更好。
接下來,作者還研究了L2的ee值與產物3a的ee值之間的關系(Figure 1b),并觀察到正相非線性效應[(+)-NLE];當用L2(60% ee)時,以91%ee值得到3a。結果表明,在反應體系中可能產生熱力學穩定的雜手性多聚體復合物,從而減少了活性催化劑的量;同時,剩余的活性復合物增加了非對映體純度,從而觀察到了不對稱放大行為。
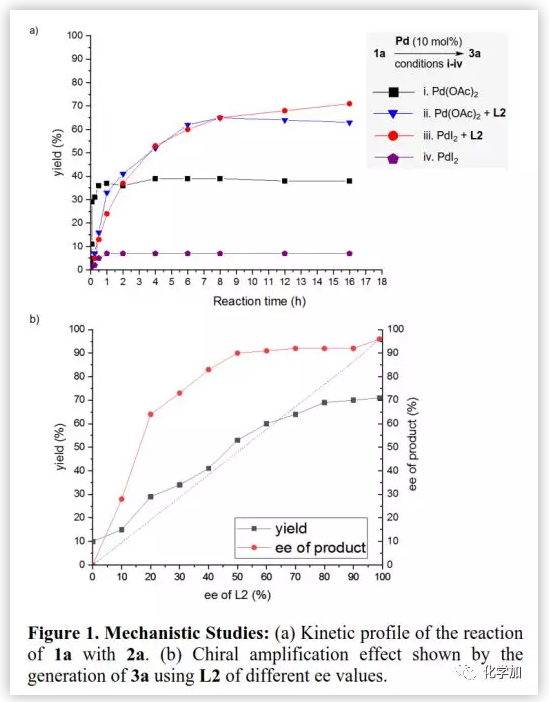
(圖片來源:J. Am. Chem. Soc.)
小結:史炳鋒課題組開發了一種手性BINOL-型配體/Pd(II)-催化的亞甲基C(sp3)-H鍵的不對稱炔化方法,并利用3,3'-二氟-BINOL作為配體觀察到正相非線性效應,證明了該配體對反應性和對映選擇性都具有顯著影響。通過機理研究表明,多種配體可參與立體控制的C-H鈀化步驟。此外,作者開發的BINOL型配體為將來其他類型的C-H官能團化反應提供了新的思路。
撰稿人:爽爽的朝陽
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn