



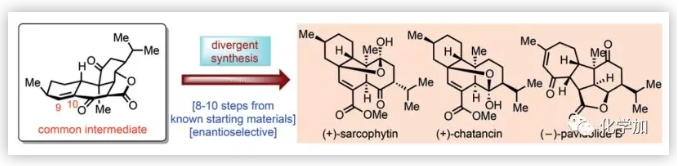
海洋珊瑚中蘊(yùn)藏著結(jié)構(gòu)多樣的西松烷型二萜類天然產(chǎn)物。自從Anjaneyulu課題組于1998年從Sarcophyton elegans中首次分離得到(+)-Sarcophytin (1)(Figure 1)以來,至今已分離得到多個Sarcophytin家族成員。西松烷內(nèi)酯的結(jié)構(gòu)特征在于含有兩個具有六個或七個手性中心的順式十氫萘片段,并通過在C10位叔醇和C3/C14位酮基之間的跨環(huán)橋連半縮酮折疊成擁擠的多環(huán)骨架;此外,該類天然產(chǎn)物具有潛在的生物活性,如(+)-Chatancin (3)是有效的血小板活化因子(PAF)拮抗劑,激發(fā)了G?ssinger、Deslongchamps、Maimone和Carreira等人對其進(jìn)行全合成研究。
(圖片來源:Angew. Chem. Int. Ed.)
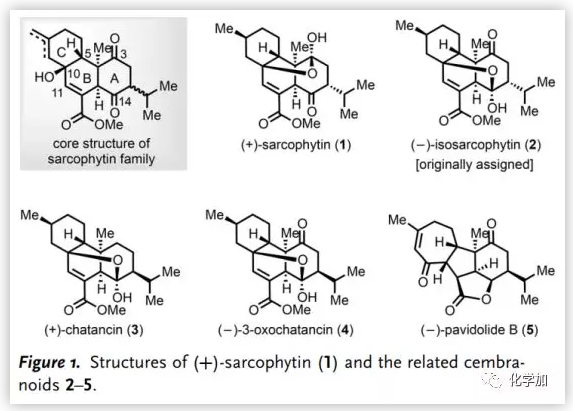
1和3以及(-)-Pavidolide B (5)是由林文瀚課題組從Sinularia pavida中分離得到并鑒定的,其中,5對多種人早幼粒細(xì)胞白血病細(xì)胞系具有高選擇性抑制活性。圓頂狀[6,5,5,7]四環(huán)體系,特別是全取代的環(huán)戊烷母核以及七個連續(xù)的手性中心,使其全合成充滿挑戰(zhàn)。2017年,楊震、龔建賢團(tuán)隊以乙烯基環(huán)丙烷的串聯(lián)自由基環(huán)化為關(guān)鍵步驟完成了5的不對稱全合成。盡管已經(jīng)提出了基于分子內(nèi)Michael/aldol反應(yīng)的5的生源途徑,但通過西松烷跨環(huán)Diels-Alder環(huán)加成構(gòu)建的Sarcophytin/Chatancin骨架中B/C環(huán)上的C5(10→11)Wagner-Meerwein重排可能是涉及5的另一種生源途徑。因此,有必要對這些西松烷內(nèi)酯的集群式合成進(jìn)行系統(tǒng)研究,以闡明其多環(huán)骨架之間的生源關(guān)系。近日,浙江大學(xué)丁寒鋒、林旭鋒課題組完成了(+)-Sarcophytin (1)、(+)-Chatancin (3)、(-)-3-Oxochatancin (4)和(-)-Pavidolide B (5)的全合成, 并對(-)-Isosarcophytin (2)進(jìn)行了結(jié)構(gòu)修正。
1-5的逆合成分析如下(Scheme 1):作者認(rèn)為Sarcophytin家族成員1-4可由反式二醇6或7通過后期官能團(tuán)化(包括不飽和甲酯的構(gòu)建、C14位的氧化態(tài)調(diào)整和/或C1位的立體化學(xué)以及半縮醛化)合成。根據(jù)5的生源假說,順式二醇8的頻哪醇重排是構(gòu)建這類天然產(chǎn)物的[6,5,7]三環(huán)碳骨架的重要手段。區(qū)別主要在C10位手性中心的二醇6-8可以由通用中間體9通過底物控制的Δ9,10-烯烴的面選擇性水合來構(gòu)建,而9可以由雙環(huán)烯酮10和格氏試劑11通過Helquist環(huán)化合成。最后,10可以由易得的手性醇(-)-12和Rawal二烯13通過雙重Mukaiyama Michael加成/消除制備。

(圖片來源:Angew. Chem. Int. Ed.)
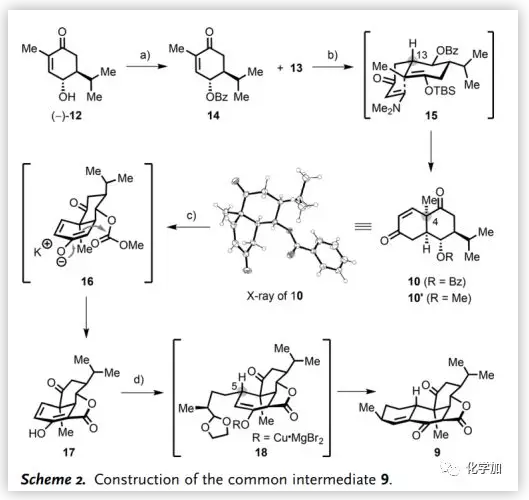
通用中間體9的構(gòu)建(Scheme 2):作者以(-)-12為原料,經(jīng)苯甲酰化得到14(95%)后,與Rawal二烯13在40 ℃進(jìn)行Mukaiyama-Michael加成得到15,為一對異構(gòu)體(d.r. 2.5:1),通過升高反應(yīng)溫度(70 ℃)顯著提高了非對映選擇性(>20:1)。將15用HF脫TBS后,進(jìn)行第二次Mukaiyama-Michael加成,然后消除得到順式-[6,6]雙環(huán)二酮10(84%),其C4位季碳的立體化學(xué)通過X-射線單晶衍射確證(Scheme 2)。用t-BuOK和碳酸二甲酯處理10經(jīng)由酯交換/Dieckmann縮合形成中間體16,引入內(nèi)酯得到17(75%)。烯醇17經(jīng)“一鍋法”Helquist環(huán)化[包括銅介導(dǎo)的立體選擇性Michael加成(11, CuBr·Me2S, HMPA)和分子內(nèi)aldol反應(yīng)(aq. HCl)]得到四環(huán)中間體9(82%)。
(圖片來源:Angew. Chem. Int. Ed.)
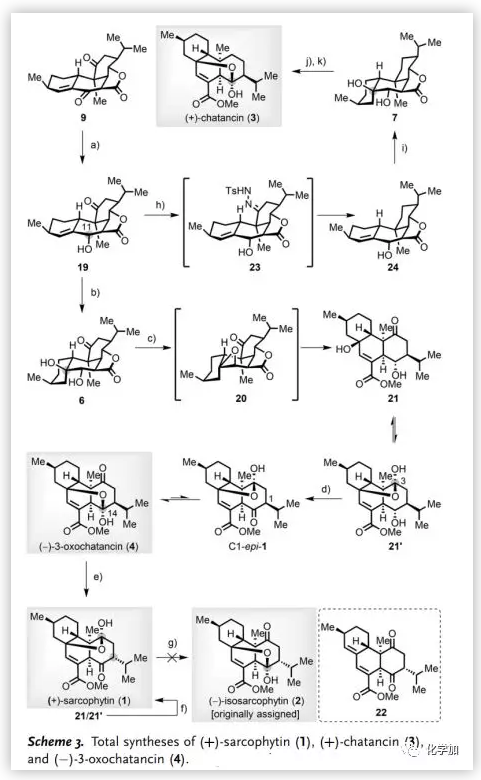
在構(gòu)建完[6,6,6]三環(huán)骨架后,作者將注意力轉(zhuǎn)向Sarcophytin家族成員1-4的全合成(Scheme 3)。利用NaBH(OAc)3對9中烯酮進(jìn)行化學(xué)和非對映選擇性1,2-還原得到單一異構(gòu)體19(76%)。受C11位羥基的位阻影響,Δ9,10-烯烴的水合有利于β-取向選擇性。經(jīng)過廣泛的條件篩選,作者采用Shenvi優(yōu)化的反應(yīng)條件[Mn(dpm)3, Ph(i-PrO)SiH2, O2, THF]將19水合得到二醇6/8(d.r. 5.6:1,80%)的混合物。反式二醇6經(jīng)MsCl/DBU處理得到環(huán)氧化中間體20,然后經(jīng)歷內(nèi)酯和環(huán)氧開環(huán)得到不飽和酯21/21'的混合物(1:1),再經(jīng)Dess-Martin氧化及后續(xù)自發(fā)半縮醛化得到(-)-3-Oxochatancin (4)及其C3區(qū)域異構(gòu)體C1-epi-1(5.2:1,95%),從而確定了其絕對構(gòu)型。在80 ℃下,用DBU處理4以82%的產(chǎn)率得到(+)-Sarcophytin (1)。此外,用RuCl3·3H2O、K2S2O8和KOH原位生成的釕酸鉀(K2RuO4)處理21/21'經(jīng)直接氧化/差向異構(gòu)化/半縮醛化也可以得到1(68%)。
遺憾的是,未能實(shí)現(xiàn)1到(-)-Isosarcophytin (2)的轉(zhuǎn)化:1對熱(甲苯,180 ℃,封管)和堿性(DBU, 甲苯, 110 ℃或NaOMe, MeOH, 65 ℃)條件均呈惰性,而在酸性條件(如催化量p-TsOH·H2O, PPTS, TMSOTf等)下迅速脫水得到22。上述結(jié)果促使作者重新鑒定了2的原始結(jié)構(gòu),并發(fā)現(xiàn)合成樣品4與天然(-)-Isosarcophytin具有相同的NMR數(shù)據(jù)。因此,作者將(-)-Isosarcophytin的結(jié)構(gòu)修正為4。甲苯磺酰腙23經(jīng)NaBH3CN/p-TsOH·H2O處理脫除酮羰基得到24(75%)。隨后,24在Mn(dpm)3-催化下水合得到反式二醇7及其C10差向異構(gòu)體(6.5:1,83%)的混合物。按照合成4的路線,將7進(jìn)一步轉(zhuǎn)化為(+)-Chatancin (3)。
(圖片來源:Angew. Chem. Int. Ed.)
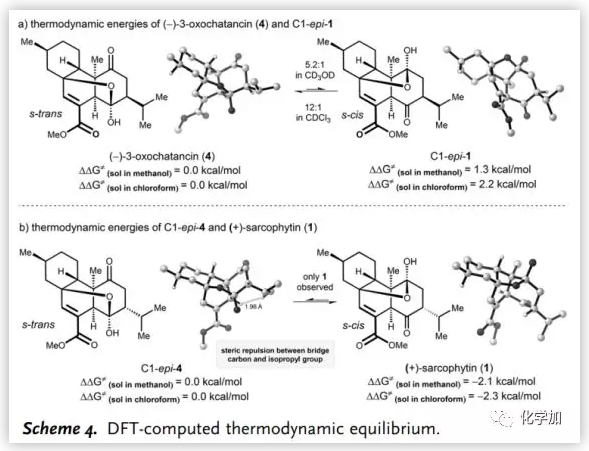
作者和浙江大學(xué)洪鑫課題組合作,通過密度泛函理論(DFT)計算解釋了4和C1-epi-1以及1和C1-epi-4之間的熱力學(xué)平衡(Scheme 4),并且計算的熱力學(xué)能量證實(shí)了實(shí)驗(yàn)結(jié)果。控制4和C1-epi-1之間平衡的關(guān)鍵因素是共軛酯的幾何形狀(Scheme 4a)。4的結(jié)構(gòu)具有優(yōu)勢的s-trans幾何結(jié)構(gòu),而相同的片段在C1-epi-1中具有s-cis幾何結(jié)構(gòu),這是由兩個羰基之間的空間排斥引起的。脫除酯基后將導(dǎo)致逆向熱力學(xué)偏向。對于C1-epi-4和1之間的平衡,由于橋碳原子和異丙基之間的空間排斥,導(dǎo)致C1-epi-4不穩(wěn)定(Scheme 4b)。
(圖片來源:Angew. Chem. Int. Ed.)
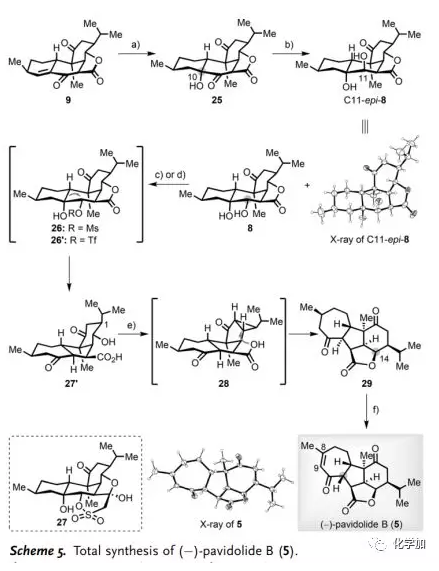
(-)-Pavidolide B(5)的全合成(Scheme 5):9經(jīng)Mukaiyama水合可以選擇性得到α-醇25(76%)。隨后,作者篩選了一系列還原劑如Zn(BH4)2、NaBH4/Et3B、L-Selectride、DIBAL-H和SmI2用于C11位酮的區(qū)域和非對映選擇性還原,并且過度還原會產(chǎn)生三醇的異構(gòu)體混合物或僅得到反式二醇C11-epi-8(Scheme 5)。幸運(yùn)的是,作者發(fā)現(xiàn)用NaBH4/Py處理25可以得到8為主要異構(gòu)體(78%),為后續(xù)頻哪醇重排奠定了基礎(chǔ)。然而,在各種Lewis酸條件下,甲磺酸鹽26均會發(fā)生分解,并且在堿性條件下發(fā)生分子內(nèi)aldol環(huán)化產(chǎn)生五環(huán)化合物27。令人高興的是,三氟甲磺酸酯26'不經(jīng)分離,在t-BuOK/t-BuOH存在下直接轉(zhuǎn)化成預(yù)期產(chǎn)物27'(69%)。在構(gòu)建出[6,5,7]三環(huán)母核骨架后,作者將注意力轉(zhuǎn)向內(nèi)酯關(guān)環(huán)、C14位立體化學(xué)反轉(zhuǎn)、C11位差向異構(gòu)化以及引入Δ8,9-雙鍵。一方面,利用Mitsunobu反應(yīng)未能實(shí)現(xiàn)27'內(nèi)酯化;另一方面,由于C1位異丙基的空間位阻影響,利用其甲磺酸鹽進(jìn)行分子內(nèi)SN2環(huán)化得到29的產(chǎn)率很低(<10%)。因此,作者不得不采取另一種策略。經(jīng)過詳盡的試驗(yàn),作者發(fā)現(xiàn)用亞化學(xué)計量的BF3·Et2O可以實(shí)現(xiàn)27'縮環(huán)得到[3,5,5,7]四環(huán)化合物28,然后用羧酸進(jìn)行分子內(nèi)親核加成導(dǎo)致環(huán)丙烷開環(huán)得到29(84%)。最后,利用Mukaiyama報道的脫氫方法,區(qū)域選擇性構(gòu)建出Δ8,9-雙鍵,伴隨在C11位差向異構(gòu)化得到(-)-Pavidolide B(5,75%)。
(圖片來源:Angew. Chem. Int. Ed.)
小結(jié):丁寒鋒、林旭鋒課題組以易得的醇(-)-12為原料經(jīng)過8~10步反應(yīng)完成了四種西松烷型二萜類化合物:(+)-Sarcophytin、(+)-Chatancin、(-)-3-Oxochatancin和(-)-Pavidolide B的全合成,并對(-)-Isosarcophytin的結(jié)構(gòu)進(jìn)行了修正。其合成策略包括雙重Mukaiyama Michael加成/消除、Helquist環(huán)化、兩種底物控制的面選擇性水和以及頻哪醇重排等。此外,后期BF3·Et2O-介導(dǎo)的直接內(nèi)酯化也是其成功的關(guān)鍵。更重要的是,這些化合物的全合成揭示了兩種不同多環(huán)骨架之間可能的生源關(guān)系。
撰稿人:爽爽的朝陽
聲明:化學(xué)加刊發(fā)或者轉(zhuǎn)載此文只是出于傳遞、分享更多信息之目的,并不意味認(rèn)同其觀點(diǎn)或證實(shí)其描述。若有來源標(biāo)注錯誤或侵犯了您的合法權(quán)益,請作者持權(quán)屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn