

(圖片來源:Angew. Chem. Int. Ed.)
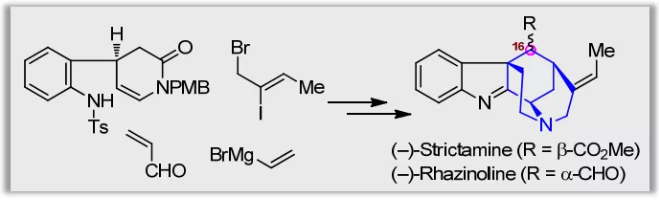
燈臺生物堿(Akuammiline alkaloid)是一類具有廣泛生物活性的單萜吲哚生物堿,主要存在于夾竹桃科( Apocynaceae) 植物中。其中,Aspidophylline A,Aalophyline A,Picrinine,Scholarisine A,Strictamine以及Vincorine作為燈臺生物堿家族的代表分子,以其復雜多樣的結構和顯著的生理活性一直受到合成化學家廣泛關注。
Strictamine類生物堿(1-3,Scheme 1A)屬于燈臺生物堿中一個重要的亞型。在結構上,它們具有一個籠狀的methanoquinolizidine核心骨架和4個手性中心,還包括C16位多樣化的取代基及空間構型,因而具有較高的合成難度。
2016年,Garg小組利用Fischer 吲哚合成策略首次實現了Strictamine的不對稱全合成。同年,祝介平課題組也完成了(±)-Strictamine的全合成工作(Angew. Chem. Int. Ed. 2016, 55, 3500.),盡管最終由鎳催化的還原Heck環化反應構建E環的關鍵反應收率較低,其所報道的中間體仍被Fujii/Ohno(Org. Lett. 2016, 18, 1670.)、Gaich(Chem. Commun. 2016, 52, 11363.; Chem. Eur. J. 2017, 23, 3938.)、Snyder(Org. Lett. 2017, 19, 1004.)、秦勇(Chem. Commun. 2017, 53, 12665.)等多個課題組在隨后針對Strictamine的形式合成中所采用。
在前期工作中,秦勇教授課題組發展了三種類型的光催化的自由基串聯反應(Chem, 2017, 2, 803.),用以高效構建三種單萜吲哚生物堿的基本骨架,包括:白堅木型(Aspidosperma, type I)、四氫咔波啉型(tetrahydrocarbolinone, type II)以及柯楠因型(Corynanthe, type III)。基于此,作者擬采用type II光催化的自由基串聯策略完成 (–)-Strictamine及(-)-Rhazinoline核心骨架的構建(Scheme 1B)。
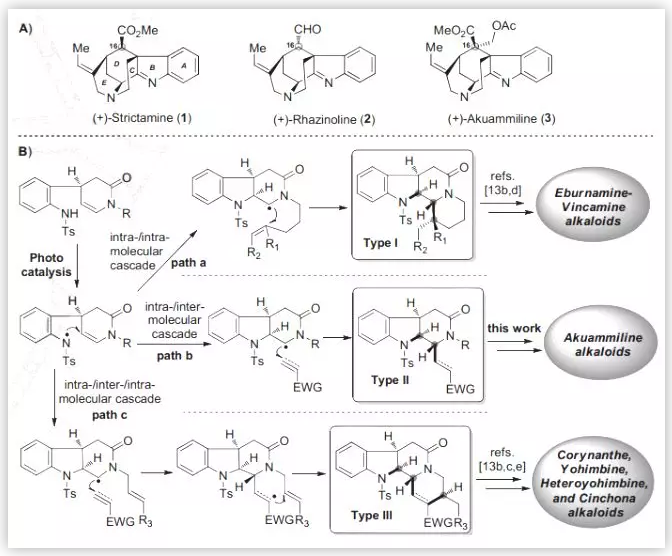
圖1. Strictamine類生物堿及秦勇課題組發展的光催化的自由基串聯反應
(圖片來源:Angew. Chem. Int. Ed.)
隨后,作者對目標分子進行了逆合成分析(Scheme 2)。考慮到當在C環存在下,E環的構建需要克服較高的能壘,因此,C環將通過化合物4的分子內的N-烷基化反應在最后構建。而E環則先于C環通過烯基碘與雙鍵的環化反應構建。D環的構建則主要通過格氏反應在醛類中間體10上引入乙烯基后,再通過分子內的Tsuji-Trost 烯丙基化反應來完成。而(–)-Strictamine及(–)-Rhazinoline 核心骨架三環內酰胺主要經由type II型光催化的自由基串聯策略構筑。
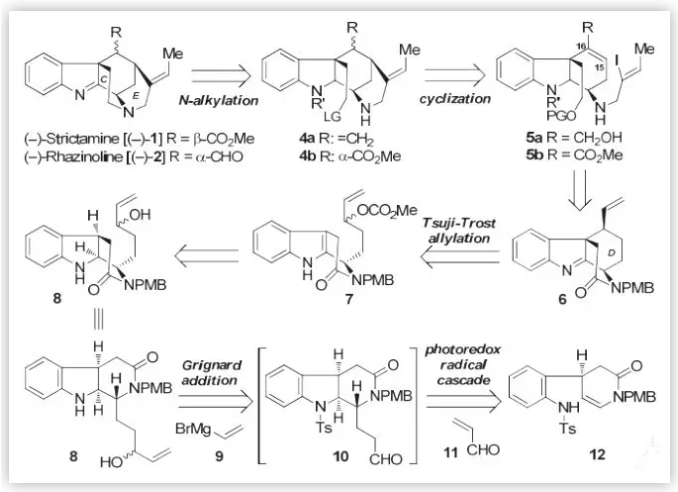
圖2. (–)-Strictamine及(–)-Rhazinoline的逆合成分析
(圖片來源:Angew. Chem. Int. Ed.)
基于上述逆合成分析,作者從簡單易得的手性醛酯13出發(Scheme 3),與對甲氧基苯胺反應以68%的收率得到烯胺化合物14,隨后對硝基進行還原、保護得到化合物12(兩步69%)。接下來,化合物12在Ir(dtbbpy)(ppy)2PF6的催化下,與丙烯醛發生分子間/分子內的串聯反應,隨后與烯基溴化鎂加成,再通過鈉/萘脫除Ts保護,“一鍋法”得到了一對三環內酰胺化合物8的非對映異構體(d.r. 1.15:1,47%)。隨后,作者在氧氣的作用下并使用氯甲酸甲酯將化合物8轉化為碳酸酯類化合物7,再通過Tsuji-Trost 反應合成了四環內酰胺14(74%)。考慮到C環對E環構筑的影響,作者通過水解酰胺鍵打開C環,同時得到了內酯化合物15(70%)。接下來,作者對化合物15進行了還原以及選擇性地保護,得到三環中間體16。
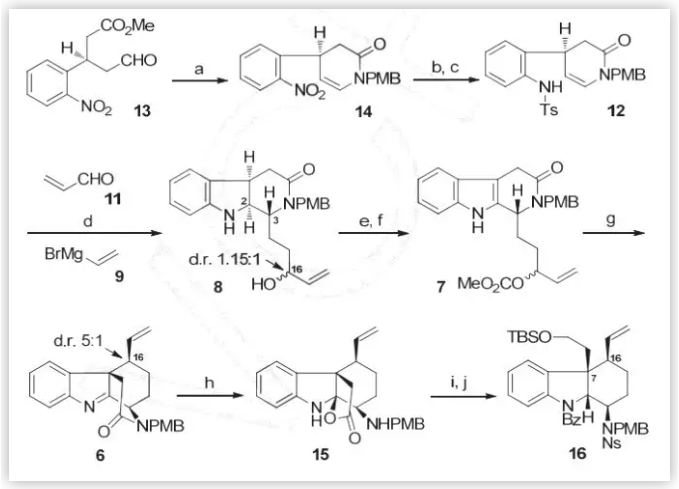
圖3. 三環中間體16的合成路線
(圖片來源:Angew. Chem. Int. Ed.)
在得到三環中間體16后,作者隨后在N4位引入合適的側鏈來進一步完成E環的構建(Scheme 4)。首先,通過OsO4/NaIO4氧化、α-位硒化消除得到烯醛化合物17,在此基礎上利用Pinnick氧化、TMSCHN2作為甲基化試劑,以兩步84%的收率將烯醛化合物17轉化為酯類化合物18。針對TBS保護基對后續反應條件的耐受性較差,作者將TBS更換為特戊酰基(95%),并將N4位的PMB及Ns保護基脫除,隨后與溴化物21反應成功的在N4位引入含有烯基碘的側鏈。接下來,通過還原Heck環化反應完成了E環的構建,并對仲胺進行Boc保護(兩步48%)。最后,作者對末端羥基脫除Piv保護并甲磺酰化,使用PCC將二氫吲哚氧化為亞胺,通過TFA脫除Boc保護的同時完成分子內的N-烷基化(兩步41%),再對C16位的酯基進行DIBAL-H還原、Swern氧化(兩步68%),成功的完成了(–)-Rhazinoline 的合成。
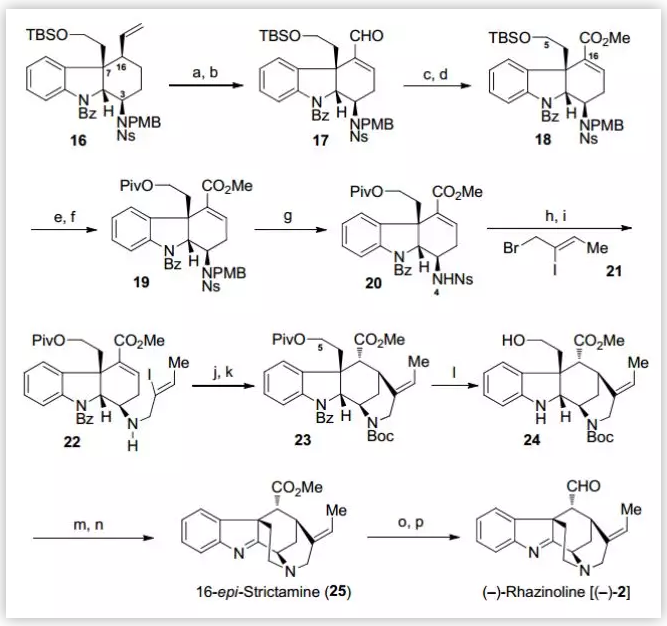
圖4. (–)-Rhazinoline 的全合成
(圖片來源:Angew. Chem. Int. Ed.)
為了使C16的基團差向異構化,進而完成(–)-Strictamine的合成,作者從三環醛類中間體17出發(Scheme 5),通過Luche還原、脫保護得到二醇化合物16,隨后使用上述類似的方法在N4位引入含有烯基碘的側鏈,并通過Ni介導的還原Heck環化反應完成E環構建的同時,在C16位引入了末端雙鍵。接下來,作者利用分子內的N-烷基化反應,以高達95%的收率,完成了C環的構建,并通過硼氫化氧化順利的得到了單一的非對映異構體31(54%)。最后,通過連續的氧化、酯化反應實現了(–)-Strictamine的全合成。
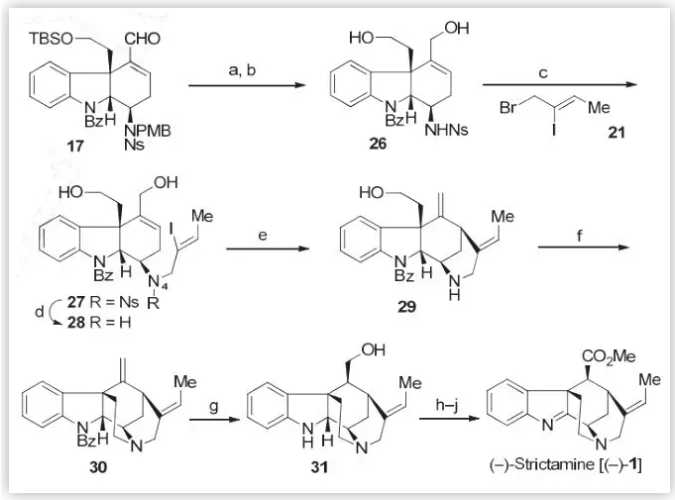
圖5 . (–)-Strictamine 的全合成
(圖片來源:Angew. Chem. Int. Ed.)
總結:四川大學華西藥學院的秦勇教授團隊借助光催化的自由基串聯反應以及過渡金屬催化的環化反應為關鍵步驟,實現了(–)-Strictamine 及 (–)-Rhazinoline 的不對稱全合成。其關鍵步驟主要包括:type II型光催化的自由基串聯策略對手性四氫咔波啉核心骨架的構建,以及Tsuji-Trost烯丙基化反應、鈀或鎳介導的還原Heck環化反應、分子內的N-烷基化反應對目標分子中D、E、C環的順序構建。這種獨特的合成策略對含有methanoquinolizidine核心骨架的燈臺類生物堿具有重要的意義。
撰稿人:L-脯氨酸
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn